�@
�y�ړI�E�ڕW�z
21���I�̐����w�́A�Q�m���v��ʼn𖾂��ꂽ��`�q�̃R�[�h����A�^���p�N���̑��ݍ�p�̃l�b�g���[�N���𖾂��āA���ꂪ�זE����̂܂ł̍\����@�\���@����d�g�݂��ؖ����邱�Ƃ��A�ڕW�ɂ����Ă��܂��B�������̌������ł́A���̖ڕW��_�o�זE�ɂ��Ă͂߁A�]�Ȋw��3��ڕW�ł���@�u�]�͂ǂ̂悤�ɂł��邩�H�i�]�̔����j�v�@�u�]�͂ǂ̂悤�ɓ������H�i�]�̉Y���j�v�@�u�]�͂ǂ�����Đ��ł��邩�H�i�]�̍Đ��j�v�@�Ɏ���u���āA������i�߂Ă��܂��B
�y�������e�z
�@�]�̓����̓V�i�v�X�Ƃ����\���P�ʂ���ՂƂ��čs���Ă��邽�߁A�V�i�v�X�̌`���͔]�̔����E�@�\�E�Đ��̑S�Ăɂ����āA�ł��d�v�Ȍ��ۂł��B���̌��ۂ́A�����~���Ƃ����^�����ɕx�\���̂��A�_�o�̓ˋN��[�Ɍ`������A���ꂪ�W�I�ƂȂ�_�o�זE�ɓ��B���Ē�~���A�V�i�v�X�I���ɕω����邱�ƂŒB�������ƍl�����Ă���A���̊ϓ_����A�����~���͔]�̐_�o��H���`���E�ĕҁE�C�������ŁA����I�ɏd�v�ȍ\���ƍl�����܂��B���̍\���̕��q���J�j�Y���́A������{�I�Ȃ��Ƃ͂킩���Ă��܂����A�V�i�v�X�Ȃǂɔ�ׂ�ƁA�����̎����S���������Ă��Ȃ����A�����B���Ȍ��_���������Ă��Ȃ��̂�����ł��B
�@�@���̌������ł́A�����~���̕��q��Ղ𖾂炩�ɂ��邱�Ƃ��K�v���ƍl���A���E�ɐ�삯�Đ����~���̃v���e�I�~�N�X�i���̕��ʂɂ���^���p�N����ԗ��I�E��ʓI�ɓ��肷�錤����@�j���s���A�����~���̕��q�}�[�J�[�ƂȂ镪�q�QnGAP�����o���܂���(PNAS 2009)�B���̌����́A�V���Ȃǂɂ����グ���A�������Ăт܂����B����Ɋ�Â��ȉ��̌������s���Ă��܂��B
�@(1) �@�}�[�J�[���q�Q�̖��������߂錤���F��X��nGAPs�̃m�b�N�A�E�g�}�E�X���쐬���A���̖����̌����ɒ��肵�Ă��܂��B
�@(2) �@�_�o�זE�̋ɐ��Ɋւ��錤���F�v���e�I�~�N�X�Ō��o�����A�����~���̖��^���p�N���ŋ@�\���m�̕��q�ɒ��ڂ��A���̉����̕��q�Q����Đ_�o�זE�̋ɐ��i�����E����ˋN�̕����j�`�������߂���邱�Ƃ����o���A���͓I�Ɍ�����i�߂Ă��܂��B
�@(3) �@�����_���v���e�I�~�N�X�̌����F�����~���̃����_���^���p�N�����A�v���e�I�~�N�X�̎�@��p���Ėԗ��I�ɉ�͂��A�����ނ̃����_�����ʂ����o���܂����B�����̖��������肷�邱�Ƃ��A�����_���R�̂�p���ď����s���Ă��܂��B���ɁA�����~����_�o�����Đ��̕��q�}�[�J�[�ɂȂ郊���_�����ʂ����o���Ă��܂��B
�@�@�R���h���C�`�����_(CS)�́A�זE�Ԋ�ƌĂ��\���ɕ��L�����z����O���R�T�~�m�O���J���ƌĂ�镨���ŁAN-�A�Z�`���K���N�g�T�~���AD-�O���N�����_�Ƃ���2��ނ̓��������J��Ԃ��ĂȂ��������i�ɗ��_������������̂ł��B�R�A�^���p�N���Ƃ����^���p�N���Ɍ������āA�v���e�I�O���J�����\�����Ă��܂��B���̕����͑S�g�ɑ��݂��܂����A�_�o�n�ł͐����~���@�\�������j�Q���镨���Ƃ��Ēm���A���̖��������ڂ���Ă��܂��B�����Đ��̍ۂɂ��A���̕����̉e���ŁA�_�o�̍Đ�������ł��邱�Ƃ��m���Ă���A�]�E�Ґ��̑����⎾���ŁA�@�\�I�ȏC��������ƂȂ��Ă��錴���ł͂Ȃ����ƍl�����Ă��܂��B
�@�@�_�o�Đ��̌����ɂ͏]���A�ۂ��琸�����ꂽ�R���h���C�`�i�[�[ABC�Ƃ���CS�����y�f���g���Ă��܂������A�ŋ߂̓��{�̌����O���[�v�����炩�ɂ���CS�����y�f�Q�ɒ��ڂ��A������i�߂Ă��܂��B���݁A2��ނ̃m�b�N�A�E�g�}�E�X���쐬���A���̂�����1��ނ��A�Ґ�������̐_�o�Đ����ɂ߂ċN����₷���Ȃ��Ă��邱�Ƃ����o���܂����B���݁A�����ɂ��āA�ȉ��̌�����i�߂Ă��܂��B
�@(1) �@�Ґ������̏C���E�Đ��̌����F�����P�ɑ�����̉����サ�Ă��邾���łȂ��A�����̌��ʂ��ǂ����R���A�����w�I�ɉ�͂�i�߂Ă��܂��B
�@(2) �@�_�o�����Ɋւ��錤���FCS�́A�_�o�̔����̏��i�K�ɊW���邽�߁A�����Ɋւ���i�߂Ă��܂��B
�@(3) �@�_�o�Y���Ɋւ��錤���FCS�̓V�i�v�X�̉Y���ɂ��傫�Ȋ֘A�����������Ƃ��Ēm���Ă���̂ŁA�����̌����Ɛ����w�̃O���[�v�ŋ����������s���āA������i�߂Ă��܂��B
�_�o�̉Y���Ƃ����]�̊�{�I�Ȑ����́A�V�i�v�X�`�B�̒��߂ɂ���Ď��s����܂��B�V�i�v�X�O���ɂ�SNARE�@�\�Ƃ������q���J�j�Y���ɂ���āA�V�i�v�X�`�B�̊�{�����ł���J�����o(exocytosis)�Ƃ������ۂ��N����܂��B����SNARE�@�\�̍ł���{�I�ȃt���[�����[�N�͏ؖ�����Ă��܂����A���ߋ@�\�̑唼�͖��m�ł��B�����̂����A�����̌������́Asyntaxin�Ƃ���SNARE�@�\�̒��j���q�ɒ��ڂ��A�������̑��ݍ�p���ؖ����Ă��܂��B���݂́ACaMKII�Ƃ����A������_�o�Y���̒��j���q���������i���ȃ����_���j�����ۂ�syntaxin�ƌ������鐫���𖾂炩�ɂ��A���̑��ݍ�p����߂���`�q���σ}�E�X���g���Č�����i�߂Ă��܂��B�����͗\�z���Ă��Ȃ������A�V�i�v�X�\����@�\�̕ω��A�܂��s���̕ω����ώ@����A������1�̃A�~�m�_�̕ω����A�]�̋@�\��傫���ω������邱�Ƃ𖾂炩�ɂ�����܂��B
�@ �זE�̒��Ŏ���̓^���p�N���ł����A�����~���ɂ͂ǂ̂悤�ȃ^���p�N�������݂���̂��A����܂ł͂��܂�킩���Ă��炸�A���ꂪ�����~���̌���������ɂ��Ă��܂����B�������̌������́A�v���e�I�~�N�X(proteomics)�Ƃ�����i�ł�����ꋓ�ɉ������܂����B�v���e�I�~�N�X�́A����n�ɑ��݂���^���p�N����ԗ��I�Ɂi���S��ނ���2,000��ވȏ�܂Łj���肷���@�ŁA�ǂ̃^���p�N�����ǂ̒��x�̗ʁA���݂��邩�A�Ƃ��������܂ł킩��܂��B�������̌������͐����~���ɂ��ăv���e�I�~�N�X��K�p���A�ꋓ��1,000��ދ߂��̕��q����c�����܂����B����͐����~���Ɋւ��āA���E�ŏ��߂Ă̌����ŁA����ɂ����͂���𐄂��i�߁A���Ȃ��Ƃ����̓��̈ꊄ�ȏオ�A�����~���ɋ����Z�k����ċǍ݂��A�܂�17��ނ̃^���p�N�������̒��ŁA�����~���̋@�\���x���镪�q�ł��邱�Ƃ��ؖ����܂���(PNAS 106: 17211-6 [‘09])�B������u�V�����������ʁv�̍����ŏڍׂɎ��グ�Ă��܂����A�����O�ő傫�Ȓ��ڂ𗁂тĂ��܂��B �����Ő_�o�����Ɋ֘A���邱�Ƃ�V���ɂ���ꂪ���o�������q�Q�́A�_�o�����֘A�^���p�N��(neuronal growth-associated proteins; nGAPs)�Ƃ��ď����A�m�b�N�A�E�g�}�E�X�Ȃǂ�����Ă��̈Ӌ`������ɖ��m�ɂ�����܂��B ����Ƀ����_���v���e�I�~�N�X�i�^���p�N���̃����_�����ʂ�ԗ��I�ɓ��肷���@�j����͂��A����̃^���p�N���̓��蕔�ʂ̃����_�����A�����~���ւ̋Ǎ݂�@�\�ɂǂ̂悤�ɊW���Ă��邩���A�זE���x�������łȂ��A�Y����Đ��Ƃ̊֘A���Œ��ׂĂ��܂��B �@
�@�@�@�@�@�@�@�@�@�@�@�@�@
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@�i�}2�j���肵�������~���`�����̐�
�@
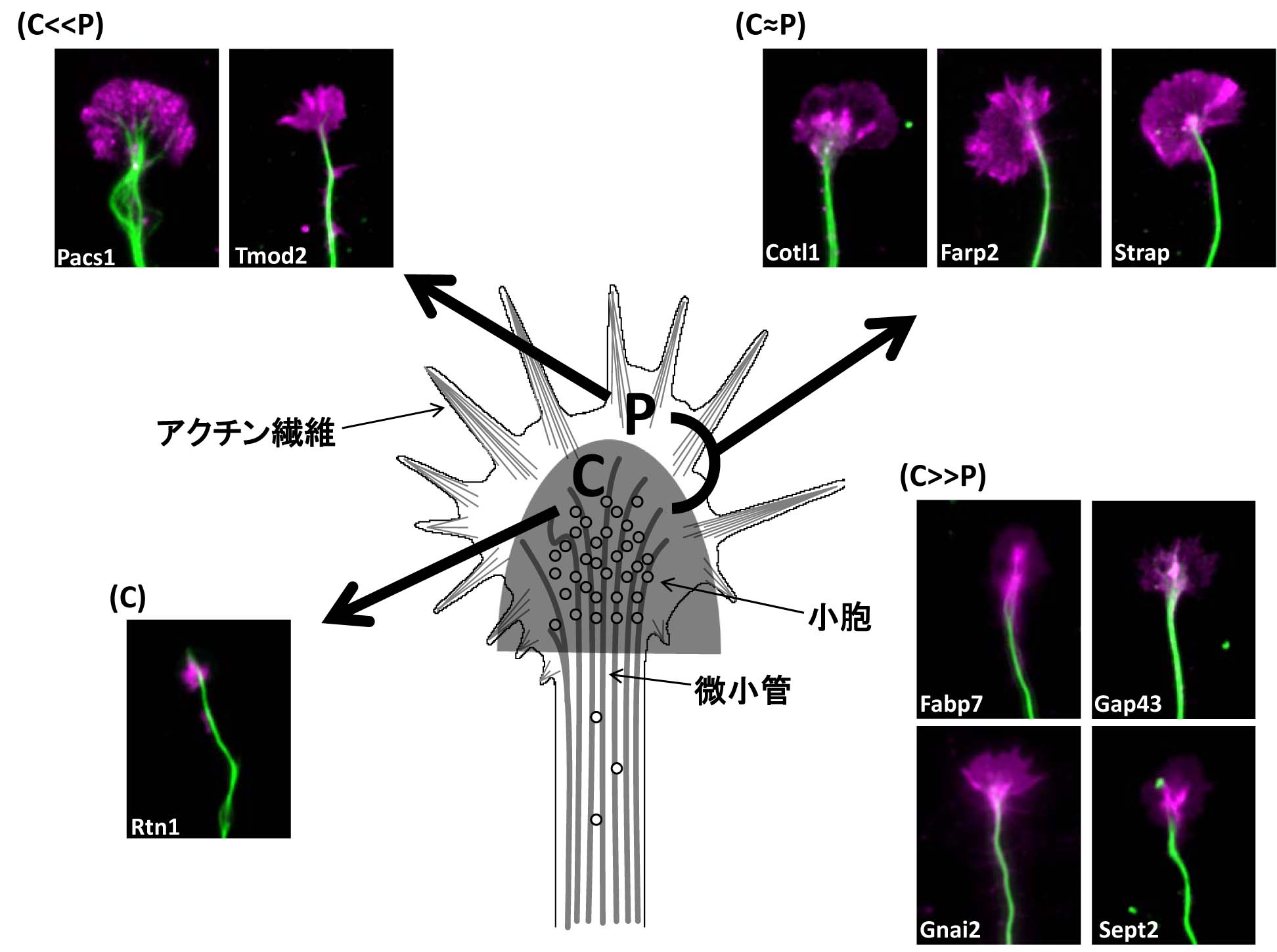
�@��L�̃v���e�I�~�N�X�Ŕ������ꂽ�^���p�N���́A�����~���@�\�̒��ŏd�v�Ȗ�����S���\���̍������q���������݂��Ă��邽�߁A���̒��œ��ɏd�v���̍������̂ɂ��āA�_�o�זE���œ������������錤�����s���Ă��܂��B�����ŃA�N�`���@�ۂƊ֘A�̐[���A20��ޒ��x�̕��q�Q�����������Ƃ���A���������Ƃɂ������̈قȂ铮�����ɕ��މ\�ł��邱�Ƃ��킩��܂����B���̂悤�ȓ��e����A�����~���̐V�����@�\��Ղ����o���邱�Ƃ����҂��Ă���A���������A���낢��ȕ��q�̉����Ɛ����~���@�\�̒Nj����s�Ȃ��Ă��܂��B
�@��L�̃v���e�I�~�N�X����A�����̏d�v�ȕ��q�����o����A���ɋ@�\���m�ł���ɂ�������炸�A�����~���ɑ������݂��镪�q������܂��B���̒��Ŏ������̌������ł́A�����~���̌`�����ɑ��݂��閌�^���p�N���ŁA�@�\���ǂ��킩���Ă��Ȃ����q�Q�ł͈�ԑ��ʂɑ��݂�����̂̂P�ł���A���^���p�N��M6a (glycoprotein m6a)�ɒ��ڂ��A���̌����^���p�N������L�̃v���e�I�~�N�X�̕��@�œ��肵�܂����BM6a�͉ߏ蔭���ő����̓ˋN�����o������������܂����A���̐����Ƃ��̃R���g���[���Ɋւ�����`�B�n���A�������̌����ŏ��X�ɂ킩���Ă��܂����B���ꂪ�_�o�̐����̒��ŁA����߂ďd�v�Ȗ������ʂ����Ă��邱�Ƃ������؋������������Ă���A���̖�����Nj����Ă����܂��B
�@�_�o�g�D�����������ꍇ�A�_�o�זE�̍Đ��͂���߂č���Ȃ��Ƃ̓q�g�̐_�o����������i����ɂ������Ɓj�ł��邱�Ƃ̌����Ƃ���Ă��܂��B�ŋ߁A�_�o�זE�̍Đ��Ɋւ����b�I�������i��ł��܂����B���n���������_�o�n�i��l�̔]�E�Ґ��j�ł͐_�o�זE���̌����̒��ɁA�����Ƃ����_�o�זE�̒����ˋN����������ƁA���̍Đ��͍���ōזE�����N���邱�Ƃ��m���Ă��܂������A���̗��R���A��������Ǝ��͂̍זE���玲���̍ĐL����W������q�i�����Đ��j�Q���q�j����������đj�Q�������邽�߂ł���炵�����Ƃ��킩��܂����B�������A���͂̍זE�͐_�o�g�D�������̃_���[�W���ŏ����ɂƂǂ߂�̂ɂ��������ʂ����Ă��邽�߁A���̖������c�����Ƃ��d�v�ł��B�������̌����O���[�v�́A�����`�q���σ}�E�X���쐬���āA����̎����Đ��j�Q���q�̓����݂̂�}����n�Ƃ��Ă̗L�p������͒��ł��B���̌�����ʂ��āA�����Đ��̃��f���n���m�����Ă��������ƍl���Ă��܂��B
�i�Q�l�j�@�\���@���O�F�����~���̋@�\���x���镪�q���.
�V���[�Y�E�o�C�I�T�C�G���X�̐V���I ��11�� �u�]�̔����E�����E�Y���v
�i�����o�Łjpp.121-32 (2002).
�@�]�̋@�\�́A���ׂăV�i�v�X�Ƃ�����b�P�ʂ���Đ����Ă��܂��B���̕����́A�_�o�Ɛ_�o���@�\�I�ɂȂ��肠���Ă��镔���ŁA�]�̉Y���i�h���ɉ������Ĕ]�̓������ω����鐫���G�w�K�E�L���Ȃǂ̊�Ձj���V�i�v�X�̐����̕ω����������ƍl�����Ă��܂��B�V�i�v�X�ɂ͂��낢��ȕ����ɕ�����Ă��܂����A�������̌������ł̓V�i�v�X�̂����A�V�i�v�X�O�I���ŋN����J�����o�̒��ߌ��ۂ��A�����w�I�Ɍ������Ă��܂��B �@�V�i�v�X�O�I���ɂ̓V�i�v�X���E�Ƃ����_�o�`�B������Z�k���Ă���\��������A�h���ɉ����i�זE�O�����Ca2+�����j���āA���E�ƌ`�������Z�����錻�ۂ��J�����o (exocytosis)�ŁA����ɂ���ď��E�̒��g�̓`�B���������o����A�V�i�v�X�㖌���̎�e�̂ƌ�������Ɠ`�B���N����܂��B �J�����o�̎��s�@�\��SNARE�@�\�ƌĂ�A���E��VAMP�ƌ`�������SNAP-25, syntaxin-1�������́iSNARE�����́j�����ƌ`�����Ə��E�̌������N�����āA���Z�����i�݂܂��B�������A���̑�̋@�\�͂킩���Ă�����̂́A���ׂ̍������ߕ����ł͓䂪�����A�]�̓����𗝉����邽�߂ɂ͂܂��܂������̃v���Z�X���𖾂����K�v������܂��B�������́A���̃V�i�v�X�`�B�̒��ŁA���ɊJ�����o�̒��߂ɊW����킸����Ca2+�Z�x�㏸(submicromolar Ca2+)�ɒ��ڂ��܂����B���̂悤��Ca2+�Z�x��K�v�Ƃ���^���p�N�����m�̌����Ƃ��āAsyntaxin-1 ��CaMKII�iCa2+/�J�����W�������ˑ����L�i�[�[II�G�]�̉Y���ɂ����Ƃ��d�v�ȃv���e�C���L�i�[�[�j�Asyntaxin-1��myosin-V�i���E�Ȃǂ�A������̂ɕK�v�ȕ��q���[�^�[�j�������A���̈Ӗ��𖾂炩�ɂ��܂���(J Neurosci 22: 3342; Mol Biol Cell 16: 4519)�B �@���̌�����i�߂āA���݂�syntaxin-1��CaMKII�Ƃ̌������ቺ�����`�q���σ}�E�X���쐬���邱�Ƃɐ������Ă��܂��B�ʔ������ƂɁA���̃}�E�X�͂������A�~�m�_�������syntaxin-1��1�Ⴄ�����Ȃ̂ɁA�h���ɑ���V�i�v�X�ł̐_�o�`�B��^���p�N���̓����i�w�p�p��ł́u���E���T�C�N�����O�v�Ƃ����܂��j�A����ɂ͍s���܂ŁA����̃}�E�X�Ƃ͑傫���قȂ��Ă��܂��B���̂悤�ɁA�]�̓�������������1�̃A�~�m�_�ňقȂ��Ă���Ӗ����A�s�Ӊ�͒��ł��B
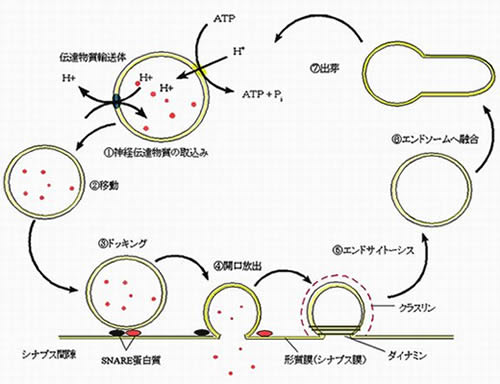
�i�}3�j�V�i�v�X���E�̓���
�@�_�o�̍Đ��͌Â�����̐_�o�Ȋw�̓��ł���A��l�̒����_�o�n�i�]��Ґ��j�̍Đ��͍��ł��ł�����I�ȃe�[�}�ł���܂��B20�N���O���炳�܂��܂Ȏ肪���肪�����A�_�o�̍Đ��́u���_��͕s�\�ł͂Ȃ��v���Ƃ��킩���Ă��܂����B�Ƃ͂����Ă��A�Տ��I�Ɏ��Âɒ�������܂łɂ́A�܂��܂������̍����n�[�h�������z���Ȃ��Ă͂Ȃ�܂���B �@�_�o�̍Đ��́A1) �_�o�זE���Đ����邱�Ɓ@2) �Đ������_�o�זE���ˋN�𐳂����L���āA�V�i�v�X�𐳂�����邱�ƁA��2�i�K���K�v�ł��B�O�҂͊��זE�̌������炢�����̗L�]�Ȍ��ʂ��o�Ă��܂����A�ʏ�̑���̍Đ��Ƃ͈���āA�_�o�n�ł͂����זE���ł��������ł͋@�\�̍Đ��͕s�\�ŁA��҂̒i�K���K�{�ł��B�����������Ƃ����_�o�זE�̏o�͕����́A�������Ă��̕ϐ����i�ނƁA�_�o�זE���̂�����ł��܂��܂��B �@�_�o�זE�̓ˋN�`���\�͂́A�_�o�̐��n�Ƌ��ɒቺ����ƍl�����i�����j�A���̌����͂܂��킩���Ă��܂���B�������A����ȊO�ɍĐ�������̂́A�]�����n����ƂƂ��ɍĐ���j�Q������q�i�O���j�������A�_�o�זE�̎��͂ɏo���オ�邩�炾�Ƃ̍l�����L�͂ɂȂ��Ă��܂��B
1. �R���h���C�`�����_�̐���Ɋւ��錤�� ���̊O���ƂȂ鎲���Đ��j�Q�����Ƃ��čő�ʂ̂��̂́A������ɔ������O���A�Ƃ����זE���Y������ƍl�����Ă���R���h���C�`�����_(Chondroitin sulfate)�Ƃ��������ł��B����̓^���p�N���ɒ������������������v���e�I�O���J���Ƃ����`������đ��݂��Ă���A�R���h���C�`�����_���̂�2��ނ̓��̌J�Ԃ��\���������Ă��܂��B2002�N�ɃR���h���C�`�����_�̕������s�Ȃ��ƁA�������̍Đ������i����邱�Ƃ�������Ĉȗ��A���̕����̌������i��ł��܂��B�������̌������ł́A�R���h���C�`�����_�̍�����}����悤�Ȉ�`�q���σ}�E�X�i�m�b�N�A�E�g�}�E�X�j������āA���̖�������͒��ł��B�܂����̃m�b�N�A�E�g�}�E�X�́A���i�̔��B��A�]�̔����Ɉُ킪�����邱�Ƃ��������̉�͂ɂ���Ă킩���Ă��܂����B���̂悤�Ȍn���g���āA����܂ł��܂茤�����i��ł��Ȃ����������I�Ȃ��̕����̈Ӌ`�ׂ邱�Ƃɂ��Ă��܂��B
2. nGAPs�Ɛ_�o�Đ� �@�_�o�����n����ƁA�����\�͂��ቺ����Ƃ��������́A�������ɋN�����Ă���ƍl�����܂����A���̗��R�͑S���킩��܂���B�������́A�����~���̋@�\�Ɋւ��錤������AnGAPs�Ƃ��������~���̋@�\���x����^���p�N���Q�������܂����B�_�o�̐������N����ɂ����Ȃ��Ă��邱�ƂƁA���n�_�o�ł����̕��q���������ɂ������Ƃ��֘A������A�����������邱�ƂŐ_�o�̍Đ������i�����\��������̂ŁA���̂悤�Ȑ����𗘗p���Č�����i�߂���܂��B
�@�@�@
�i�}4�j���o����nGAP�̕���
�����~���ɂ͂���܂ł��܂萔�����̃^���p�N�������肳��Ă��炸�A���̋@�\����͂����ŁA�傫�Ȏx��ɂȂ��Ă��܂����B�܂������~��������t����^���p�N���i�}�[�J�[���q�܂��͕��q�}�[�J�[�j��GAP-43�Ƃ����A������@�\���\���ɂ͂킩���Ă��Ȃ��^���p�N���݂̂ł����B�������̌������ł́A�����~���ɂ��ĕ��q���x���̌�����i�W�����邽�߂ɂ́A�����~���̃^���p�N���\�����͂����肳���A����Ƀ}�[�J�[���q�����o�����Ƃ��K�v�s�����ƍl���āA�ȉ��̌������s���܂����B �@�����~���̕��q�\���𖾂炩�ɂ��邽�߁A�v���e�I�~�N�X�ƌ������@�ł����悻1,000��ނ̃^���p�N���肵�܂����B��������ɁA�|�{�_�o�זE�̐����~���𑼂̕��ʂ��Z�����ߏo�����q��100��ދ߂������A����ɂ��̒�����RNAi�ƌ������@�Ő����~���̍ł��d�v�ȋ@�\�ł���_�o�̐�����}���镪�q��17��ތ��o���܂����B�u�����~���ɔZ�k����Ă��āA�����~���̋@�\�ɕK�v�s���ȕ��q�v�ł��邱���̃^���p�N�����A�_�o�����֘A�^���p�N��(neuronal growth-associated proteins; nGAPs)�Ƃ��āA�����~���̕��q�}�[�J�[�Ƃ��Ċm�����čs���܂��B �@���̌����́A��w�E�����w�W�̍ŏd�v�W���[�i����1�ł���”PNAS”�i�č��Ȋw�A�J�f�~�[�I�v�j�Ɉ�ʓ��e(Track II)�Ƃ��č̗p����A�f�ڍ��̕\���i2009�N10��6�����j�Ƃ��đ傫�����グ���܂����B
Motohiro Nozumi, Tetsuya Togano, Kazuko Takahashi-Niki, Jia Lu, Atsuko Honda, Masato Taoka, Takashi Shinkawa, Hisashi Koga, Kosei Takeuchi, Toshiaki Isobe, and Michihiro Igarashi.
Identification of functional marker proteins in the mammalian growth cone.
PNAS 2009 106 (40) 17211-17216; doi:10.1073/pnas.0904092106
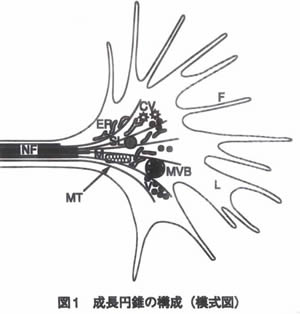
��X�̏��E�iV:large core secile, CV:coated vesicle MVB: multivesicular body�j�⏬�E��(ER�j , �Q�����\�\�[��(SL�j, �~�g�R���h���A(M)�Ȃǂ̍זE�����튯��C�̈���\������B������(MT)����������, �A�N�`���@�\���t�B���|�f�B�A(F)������|�f�B�A(L)�ɕ��z����B�j���[���t�B�������g(MF)�͐����~���ɂ͓��荞�܂Ȃ��B
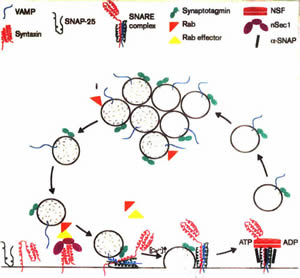
�����̒`���������̃v���Z�X�Ɋ֗^����炵���̂ł����A���m�ȃ��J�j�Y���͂܂����S�ɂ͂킩���Ă��܂���B
�i�}�� Misura et al. �̘_�����j
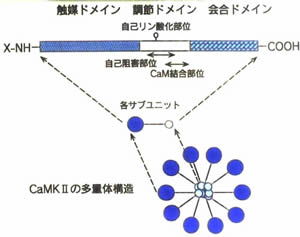
CaMKII�͔]�̉Y���ɏd�v�Ȓ`�����ł����A���@�\���ɂ��Č��������i��ł��܂��B
�i�}�͎R���t�q�搶�̑������j