感覚上皮帯の「ナノ振動」の計測と解析 (研究内容にもどる)
【研究内容の概略】
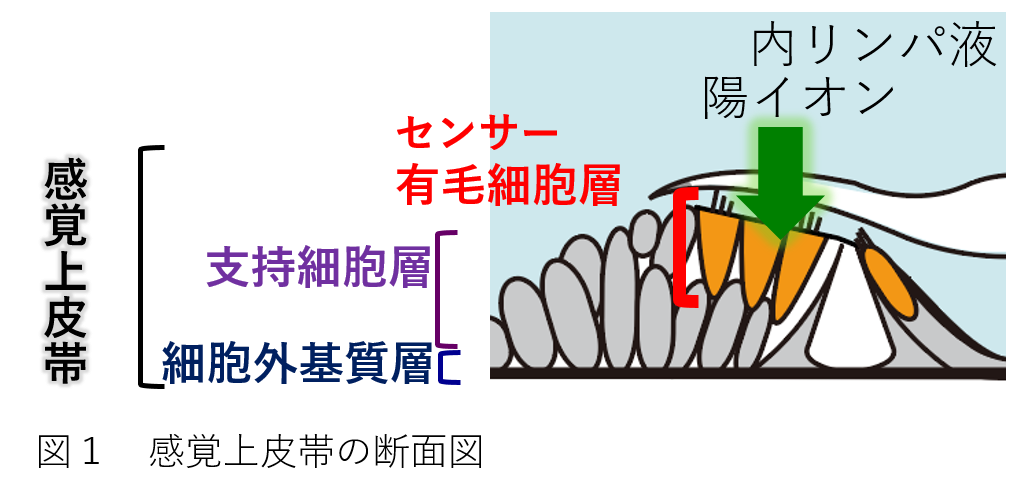 内耳蝸牛には「感覚上皮帯」と呼ばれる重要な組織が備わっています。感覚上皮帯は、センサーである有毛細胞層、支持細胞層、そして膜状組織である基底板の三層からなります
(図1)。ここで、内耳における音伝達の仕組みを、再度、簡単にご紹介します。まず、基底板が振動を受け、感覚上皮帯全体が揺れます。次に、有毛細胞の感覚毛が屈曲し、その頂部にある機械刺激感受性イオンチャネルが開きます。すると、内リンパ液に豊富にあるK+がチャネルを通って有毛細胞に流入し、細胞を電気興奮させます。すなわち、この過程で、“音の機械的(物理的)刺激が電気信号に変換”されることになります。
内耳蝸牛には「感覚上皮帯」と呼ばれる重要な組織が備わっています。感覚上皮帯は、センサーである有毛細胞層、支持細胞層、そして膜状組織である基底板の三層からなります
(図1)。ここで、内耳における音伝達の仕組みを、再度、簡単にご紹介します。まず、基底板が振動を受け、感覚上皮帯全体が揺れます。次に、有毛細胞の感覚毛が屈曲し、その頂部にある機械刺激感受性イオンチャネルが開きます。すると、内リンパ液に豊富にあるK+がチャネルを通って有毛細胞に流入し、細胞を電気興奮させます。すなわち、この過程で、“音の機械的(物理的)刺激が電気信号に変換”されることになります。
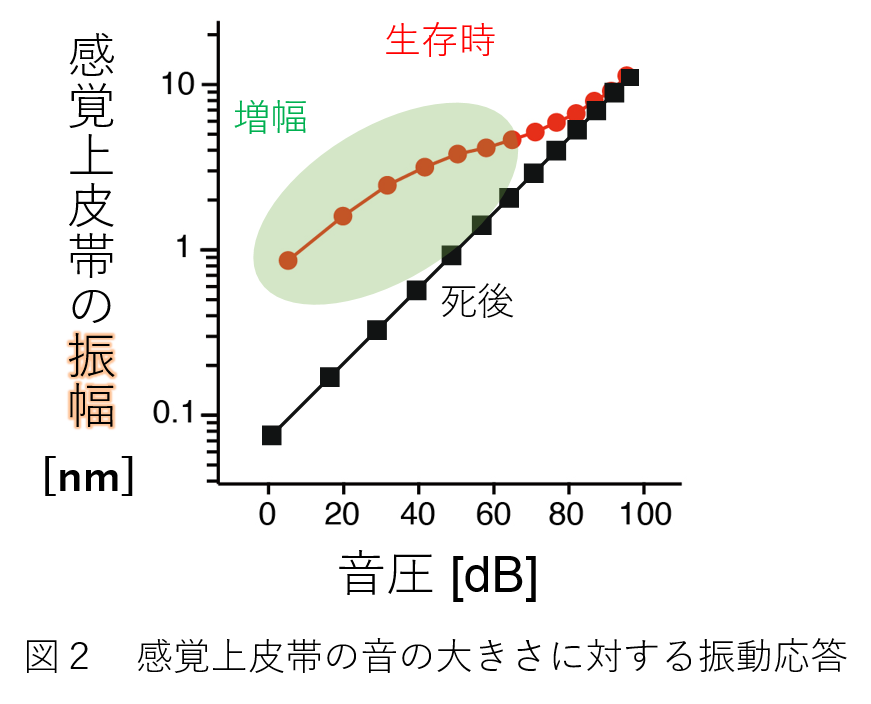
さて、わたしたちの聴覚は、小さい音を強く増幅して効率よく捉える一方で、大きい音ほど鈍く感知します。 この特徴を支える主要要因が、感覚上皮帯の振動様式です。図2は、様々な大きさの音を動物に入力した時の上皮帯振動の揺れ幅を表しています。 上述した特徴が良くわかります。これは、「非線形的な反応」と呼ばれ、動物が死んでしまうと消失してしまいます。さらに注目したいのは、上皮帯振動が極めて微小であることです。 図2に見られるように、最小で約0.1ナノメートル(1ミリの1,000万分の1)、最大でも10ナノメートルです。この差を計算すると、100倍になります。 わたしたちは、3メートル先の蚊の羽音から直近の飛行機のジェットエンジン音を聴くことができますが、これは音の圧力差としては100万倍に相当します。 これが、たった100倍の感覚上皮帯の振動に置き換えられているのです。この広いダイナミックレンジは、すでに述べた非線形的な反応の結果に他ならないのです。 また、非線形的な増幅によって、わたしたちの鋭い周波数弁別能も成り立っています。
 蝸牛から分離した有毛細胞は、人工的に電気興奮させると変形することが知られています。
これが、上皮帯振動の非線形的な反応の原因として想定されています。しかし、生体内でどのように動いているか、また、どのように支持細胞層や基底板の振動と共役しているかは、十分に明らかではありません。
わたしたちは、この重要課題に挑戦しています。上皮帯のナノ振動の計測には、「光の干渉」を使う必要があります。
わたしたちは、本学工学部の研究者と協働し、独自のレーザー干渉計(成果1)や光エコー装置(Optical Coherence Tomography:OCT)を創り(成果2-5)、特徴ある感覚上皮帯の振動の成立メカニズムを探っています。
詳しくは、機器説明のページや共同研究者の崔 森悦のホームページをご覧ください。
なお、本プロジェクトは、国立研究開発法人日本医療研究開発機構(AMED)のCREST研究「メカノバイオロジー」の支援を受けています。
蝸牛から分離した有毛細胞は、人工的に電気興奮させると変形することが知られています。
これが、上皮帯振動の非線形的な反応の原因として想定されています。しかし、生体内でどのように動いているか、また、どのように支持細胞層や基底板の振動と共役しているかは、十分に明らかではありません。
わたしたちは、この重要課題に挑戦しています。上皮帯のナノ振動の計測には、「光の干渉」を使う必要があります。
わたしたちは、本学工学部の研究者と協働し、独自のレーザー干渉計(成果1)や光エコー装置(Optical Coherence Tomography:OCT)を創り(成果2-5)、特徴ある感覚上皮帯の振動の成立メカニズムを探っています。
詳しくは、機器説明のページや共同研究者の崔 森悦のホームページをご覧ください。
なお、本プロジェクトは、国立研究開発法人日本医療研究開発機構(AMED)のCREST研究「メカノバイオロジー」の支援を受けています。
【実験手法】
装置やプログラムを、ほぼ全て自作しています。外見などは、計測機器のページをご覧ください。
(1)レーザー干渉計:感覚上皮帯の振動を高精度に測定することができます。ただ、一点のみの情報取得に限ります。断層撮影もできません。しかし、わたしたちの干渉計は、安価で、大部分の市販品では捉えることのできないパラメータを追うことができます。
(2)en-face OCT:xy(平面)方向に一括同時撮像(en-face:アンファスという)しながら、振動を計測できる優れものです。z軸方向に断層も可能です。工学部の崔 森悦が中心になって開発しています。


