新潟大学大学院医歯学総合研究科
腎医学医療センター
当講座は2007年に開講し①包括的腎代替医療の実践、②臨床遺伝子医学の発展を活動理念としております。①包括的腎代替療法では特に、本県の腹膜透析患者の診療および病診連携を活用した慢性腎臓病の診療に力を注いでいます。②臨床遺伝子医学ではファブリー病を遺伝性慢性腎臓病と捉えて、遺伝子解析、病態の解明に努めています。
ご挨拶
私は腎臓内科医として1993年から透析アミロイドーシスのモデルマウスの作製をはじめました。残念ながら成功には至りませんでしたが、遺伝子研究の基礎を習得することができました。1997年からプラスミドDNAによる筋肉、皮膚、肝臓への遺伝子導入に携わり、2002年にプラスミドDNAを腎静脈から逆行性に腎臓に導入する方法を開発しました。この方法を用いた遺伝子治療の対象疾患として腎臓が主要な標的臓器であるファブリー病を選択したことがファブリー病研究のきっかけです。2002年から薬理学的シャペロン治療を開発した石井達先生と共同研究を継続しています。
基礎的研究としてはファブリー病モデルマウスを作製し、ファブリー病の病態の解明に努めて、mTAL障害による二次性副甲状腺機能亢進症が骨再吸収の増加と骨軟化症を引き起こしていることを見出しました。
また、臨床的研究としてはファブリー病を遺伝性慢性腎臓病と捉えて、ファブリー病のスクリーニングを進めています。血漿lyso-Gb3がファブリー病の一次スクリーニングとして有用であるという当講座の研究結果から、ファブリー病が疑われる患者さんの血漿lyso-Gb3測定とα-ガラクトシダーゼA活性測定、遺伝子解析を行い診断に貢献しています。
さらに血漿lyso-Gb3が治療効果の指標としても有用であるかを検討し、報告しました。
今後もバランスのとれた腎不全医療が提供されることを目標に、慢性腎臓病から血液透析、腹膜透析、腎移植を三本柱とする腎代替医療までを包括した診療・研究体制で、より一層努力していきます。
特任教授 丸山弘樹
構成員
特任教授: 丸山弘樹
特任助教: 田口惇美
技術補佐員: 三亀真理子
研究室
ファブリー病の臨床的研究
古典型・遅発型ともに生命予後に関わる腎疾患、心疾患、脳血管疾患が出現し進行します。これらを有する人々をハイリスク群と捉えて潜在するファブリー病患者を早期に発見することが大事です。しかしすべての方に遺伝子解析を行なうことは現実的ではありません。いずれの症状も非特徴的な症状であるため、スクリーニングの精度を上げるにはファブリー病診断のバイオマーカーが必要になります。
GLA活性は男性患者には有用ですが、女性患者はGLA活性が基準値内におさまることが多くGLA解析によるスクリーニングが推奨されています。これでは多数のファブリー病でない人もストレスのかかるGLA解析を受けることになります。2008年に、すでに診断がついている古典型患者では血漿lyso-Gb3が高値を示すことが報告されました1)。
そこで私たちは血漿lyso-Gb3濃度とGLA活性を一次スクリーニング、GLA解析を二次スクリーニングに用いることで上記の課題の解決を図りました2,3)。2014年7月1日から2016年12月31日までの間に、国内237の施設(循環器内科、腎臓内科、神経内科、小児科)から紹介された5,691人(男性3,439人)のファブリー病を示唆する症状を有する患者を対象にスクリーニングを行ないました。血漿lyso-Gb3濃度が高く(≧2.0 ng/ml)かつGLA活性が低い(<4.0 nmol/h/ml)男性13人のうち、GLA解析を希望した11人すべてにGLA変異が認められました(古典型4人、遅発型7人)。また血漿lyso-Gb3濃度が高い19人の女性のうち、11人は低いGLA活性を示し(GLA変異8人;古典型6人、遅発型2人)、8人は正常なGLA活性を示しました(GLA変異5人;古典型1人、意義不明変異4人)。
今回の私たちのスクリーニング戦略ではGLA活性が正常であるファブリー病患者も検出できました。血漿lyso-Gb3濃度とGLA活性は古典型および遅発型のファブリー病患者の診断に有用な一次スクリーニングであると考えられます。
ファブリー病の基礎的研究
1. 進行性の腎障害を示すファブリー病モデルマウスの作製
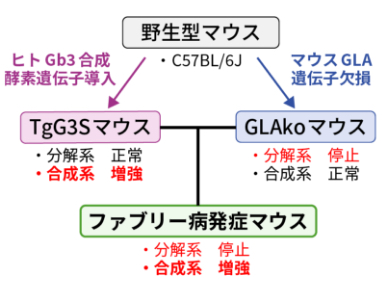
Gla遺伝子欠損マウス(GLAko)4)はGb3の蓄積が少なく無症状のためモデルとしては不十分でした。この理由としてGb3の代謝過程において分解系の欠損だけではGb3の負荷不足であると考え、Gb3合成を増強するためにヒトGb3合成酵素遺伝子を過剰発現させたマウス(TgG3S)を作製しました。さらにGLAkoマウスと交配しGb3蓄積を増強することで、多尿と進行性の腎機能障害を呈する新規ファブリー病発症マウスを作製しました5)。
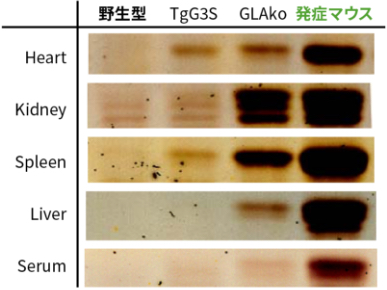
ファブリー病発症マウスの特徴を明らかにするため、バックグラウンドの3系統のマウスと比較しました。ファブリー病発症マウスは他のマウスに比べて組織Gb3の顕著な蓄積を認めました。15週齢までは順調な体重増加を示し、外見上異常は認められませんが、20週齢頃から体重の減少に伴って震えや脊柱湾曲が確認され、25週から35週齢で死亡しました。尿量が約4倍に増加し、尿浸透圧は約30%に低下しており、尿の濃縮力低下が認められました。また腎臓の電顕観察では糸球体の足細胞や遠位尿細管に封入体が確認されました。さらに組換えGLA製剤の投与によりGb3蓄積量を約40%まで減少させ、尿量を約80%に抑えることができました。
GLAko、TgG3Sでは認められない症状が、両者の性質を兼ね備えたファブリー病発症マウスで見られたことで当初の我々の仮説の妥当性が示され、Gb3の蓄積がファブリー病の発症に繋がることをマウスモデルで初めて証明しました。
(A)
(B)
(C)
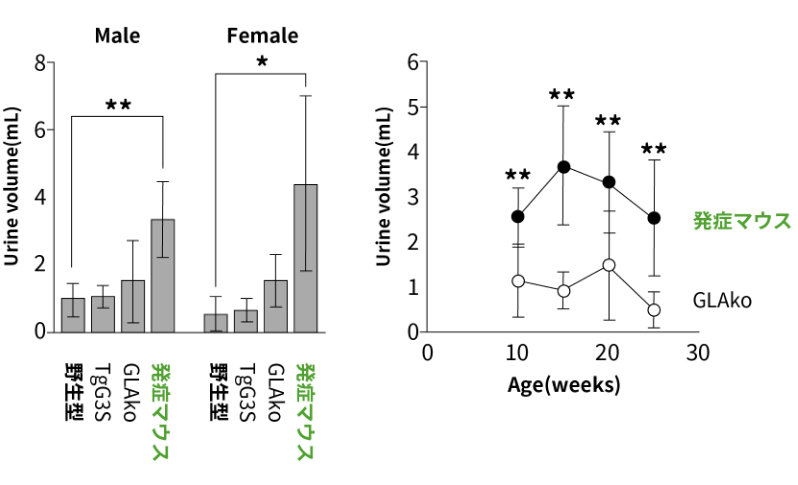
図1 ファブリー病発症モデルマウスの特徴
(A) ファブリー病発症マウスは分解系欠損と合成系増強の両方からGb3蓄積を誘導します。
(B) このファブリー病発症モデルマウスは3系統のマウスと比較して、主要な臓器・血清でGb3蓄積が顕著に増加していました。
(C) 20週齢の各系統における1日あたりの尿量(左)と、週齢ごとの変化(右)です。ファブリー病発症モデルマウスは10週齢から有意に尿量が増加していました。
2. モデルマウスを用いたファブリー腎症の解析
腎障害はファブリー病の予後に関わります。ファブリー腎症は主に蛋白尿や末期腎不全をきたす糸球体障害の病態の解明について研究されてきました。一方尿細管障害として多尿が報告されていましたがその機序は解明されていませんでした。尿細管障害については、Gb3がもっとも蓄積する部位は髄質ヘンレの太い上行脚(TAL)であること6)、酵素補充療法ではGb3が蓄積しやすい遠位尿細管細胞には酵素が移行しにくく7)、Gb3が除去されにくいこと8)が報告されました。糸球体障害だけでなく尿細管障害も腎症の治療成績に大きく関与すると推察されます。
ファブリー病発症マウスは多尿を示します。マウスの腎臓は小さいので、腎臓全体を含む断面を作製することが可能であり、尿細管全体を俯瞰できます。糸球体で作られた原尿は、近位尿細管、ヘンレの太い上行脚(遠位直尿細管:TAL)、遠位曲尿細管(DCT)、集合管(CD)を通る間に電解質や水の再吸収を受けて濃縮されます。電解質や水を再吸収するために各尿細管には特異的なタンパク質が発現しています。そこで、これらのタンパク質に結合する抗体を用いた免疫染色でTAL、DCT、CDを同定して、ファブリー病発症マウスの多尿のメカニズムを解析しました9)。
ファブリー病発症マウスで最も障害されていたのはTAL細胞でした。髄質TALではGb3が高度に蓄積していました。Na+の再吸収に関わる3つの分子(ウロモジュリン、Na+-K+-2Cl−共輸送体、Na+-K+-ATPase)の発現が低下し、高エネルギー産生・消費に関わる特徴的な構造が失われていました。また髄質TAL周囲の線維化が進行性の腎機能障害をきたすことを明らかにしました。腎生検標本の観察から患者においても同様の髄質TAL障害を確認しました。
ファブリー病発症マウスにおいて髄質TAL障害による尿の濃縮力低下が多尿の原因であることを見出しました。これらはファブリー腎症における髄質TAL障害の重要性を示唆しています。
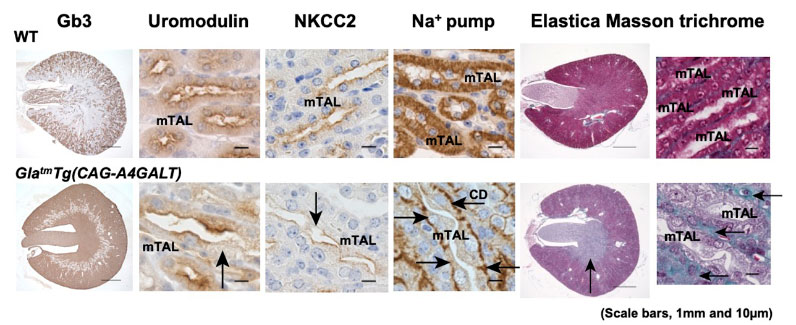
図2 ファブリー病モデルマウスの腎症状
20週齢ファブリー病発症(GlatmTg(CAG-A4GALT))マウスは野生型(WT)マウスと比較して、腎臓髄質TAL(mTAL)でのGb3蓄積、細胞障害が顕著でした。重要な膜タンパクであるウロモジュリン、Na+-K+-2Cl−共輸送体(NKCC2)、Na+-K+-ATPase(Na+ pump)の発現が低下していました。
またElastica Masson trichrome染色を行ない、ファブリー病発症マウスで尿細管間質の線維化が進行していることを確認しました。
3. モデルマウスを用いたファブリー骨症の解析
骨密度の低下がファブリー病の新しい特徴として報告されています。骨密度検査(DEXA法)を行なった男性古典型ファブリー病患者の87%において骨密度低下が認められました10)。しかしこれらの報告では、DEXA法を用いた骨密度測定のみで骨粗鬆症と診断されています。2つの代謝性骨疾患(骨粗鬆症および骨軟化症)が骨密度を低下させますが、これらの病態と治療法は全く異なります。DEXA法だけではファブリー病の正確な骨症状の診断および骨病態の機序は不明です。私たちは腎症状を呈するファブリー病発症マウスを用いて骨症状を解析しました11)。
ファブリー病発症マウスは野生型に比べて体格が劣り、体重と脛骨長が有意に減少していました。また、骨密度が低下していました。骨吸収が亢進し、石灰化が障害され、類骨の割合が有意に増加していました。ファブリー病発症マウスでは骨軟化症が起こっていることがわかりました。
血中Ca2+濃度は5週齢で低下していました。血漿P濃度は5週齢では変化がなく、10週齢で野生型に比べて有意に低下、20週齢で有意に上昇していました。尿中P濃度は5週齢から増加傾向にあり、10週齢で有意に上昇していました。血漿副甲状腺ホルモン(PTH)は5週齢から上昇していました。血漿線維芽細胞増殖因子23(FGF-23)は遅れて20週齢で上昇していました。活性型ビタミンD(1,25(OH)2D3)は変化せず、ビタミンD欠乏は認められませんでした。
ファブリー病発症マウスでは、髄質TAL障害によるPTH上昇、低Ca2+血症、二次性副甲状腺機能亢進症からの高P血症・高P尿症が、骨吸収促進による骨密度低下と骨軟化症を引き起こしていることを見出しました。
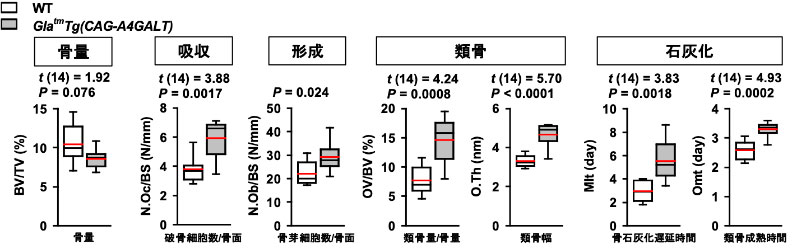
図3 ファブリー病モデルマウスの骨症状
ファブリー病発症(GlatmTg(CAG-A4GALT))マウスの骨形態を測定したところ、野生型(WT)マウスと比較して骨吸収が亢進していました。骨量の変化はありませんでしたが、石灰化が障害され、類骨の割合が有意に増加していました。骨形成促進と骨軟化症が起こっていました。
市民公開セミナー『天地腎』の開催
慢性腎臓病を中心とした生活習慣、運動・食事・薬物療法、腎代替医療について市民公開セミナーを開催しています。毎年多くの方の御来場をいただき市民のみなさまの腎臓疾患・透析医療の関心の高さがうかがわれます。今後もみなさまに貢献できるよう管理栄養士、理学療法士、医師、看護師と協力していく所存です。
参考文献
- Aerts JM, Groener JE, Kuiper S, Donker-Koopman WE, Strijland A, Ottenhoff R, van Roomen C, Mirzaian M, Wijburg FA, Linthorst GE, Vedder AC, Rombach SM, Cox-Brinkman J, Somerharju P, Boot RG, Hollak CE, Brady RO, Poorthuis BJ. Elevated globotriaosylsphingosine is a hallmark of Fabry disease. Proc Natl Acad Sci U S A. 2008, 105(8):2812–2817, DOI: 10.1073/pnas.0712309105.
- Maruyama H, Miyata K, Mikame M, Taguchi A, Guili C, Shimura M, Murayama K, Inoue T, Yamamoto S, Sugimura K, Tamita K, Kawasaki T, Kajihara J, Onishi A, Sugiyama H, Sakai T, Murata I, Oda T, Toyoda S, Hanawa K, Fujimura T, Ura S, Matsumura M, Takano H, Yamashita S, Matsukura G, Tazawa R, Shiga T, Ebato M, Satoh H, Ishii S. Effectiveness of plasma lyso-Gb3 as a biomarker for selecting high-risk patients with Fabry disease from multispecialty clinics for genetic analysis. Genet Med. 2019, 21(1):44–42, DOI: 10.1038/gim.2018.31.
- Maruyama H, Taguchi A, Mikame M, Izawa A, Morito N, Izaki K, Seto T, Onishi A, Sugiyama H, Sakai N, Yamabe K, Yokoyama Y, Yamashita S, Satoh H, Toyoda S, Hosojima M, Ito Y, Tazawa R, Ishii S. Plasma globotriaosylsphingosine and α-galactosidase A activity as a combined screening biomarker for Fabry disease in a large Japanese cohort. Curr Issues Mol Biol. 2021, 43(1):389–404, DOI: 10.3390/cimb43010032.
- Ohshima T, Murray GJ, Swaim WD, Longenecker G, Quirk JM, Cardarelli CO, Sugimoto Y, Pastan I, Gottesman MM, Brady RO, Kulkarni AB. alpha-Galactosidase A deficient mice: a model of Fabry disease. Proc Natl Acad Sci U S A. 1997, 94(6):2540–2544, DOI: 10.1073/pnas.94.6.2540.
- Taguchi A, Maruyama H, Nameta M, Yamamoto T, Matsuda J, Kulkarni AB, Yoshioka H, Ishii S. A symptomatic Fabry disease mouse model generated by inducing globotriaosylceramide synthesis. Biochem J. 2013, 456(3):373–383, DOI: 10.1042/BJ20130825.
- Vylet’al P, Hůlková H, Zivná M, Berná L, Novák P, Elleder M, Kmoch S. Abnormal expression and processing of uromodulin in Fabry disease reflects tubular cell storage alteration and is reversible by enzyme replacement therapy. J Inherit Metab Dis. 2008, 31(4):508–517, DOI: 10.1007/s10545-008-0900-3.
- Christensen EI, Zhou Q, Sørensen SS, Rasmussen AK, Jacobsen C, Feldt-Rasmussen U, Nielsen R. Distribution of alpha-galactosidase A in normal human kidney and renal accumulation and distribution of recombinant alpha-galactosidase A in Fabry mice. J Am Soc Nephrol. 2007, 18(3):698–706, DOI: 10.1681/ASN.2006080822.
- Tøndel C, Bostad L, Larsen KK, Hirth A, Vikse BE, Houge G, Svarstad E. Agalsidase benefits renal histology in young patients with Fabry disease. J Am Soc Nephrol. 2013, 24(1):137–148, DOI: 10.1681/ASN.2012030316.
- Maruyama H, Taguchi A, Nishikawa Y, Guili C, Mikame M, Nameta M, Yamaguchi Y, Ueno M, Imai N, Ito Y, Nakagawa T, Narita I, Ishii S. Medullary thick ascending limb impairment in the GlatmTg(CAG-A4GALT) Fabry model mice. FASEB J. 2018, 32(8):4544–4559, DOI: 10.1096/fj.201701374R.
- Germain DP, Benistan K, Boutouyrie P, Mutschler C. Osteopenia and osteoporosis: previously unrecognized manifestations of Fabry disease. Clin Genet. 2005, 68(1):93–95, DOI: 10.1111/j.1399-0004.2005.00457.x.
- Maruyama H, Taguchi A, Mikame M, Lu H, Tada N, Ishijima M, Kaneko H, Kawai M, Goto S, Saito A, Ohashi R, Nishikawa Y, Ishii S. Low bone mineral density due to secondary hyperparathyroidism in the GlatmTg(CAG-A4GALT) mouse model of Fabry disease. FASEB Bioadv. 2020, 2(6):365–381, DOI: 10.1096/fba.2019-00080.
研究業績
-
Maruyama H, Taguchi A, Mikame M, Izawa A, Morito N, Izaki K, Seto T, Onishi A, Sugiyama H, Sakai N, Yamabe K, Yokoyama Y, Yamashita S, Satoh H, Toyoda S, Hosojima M, Ito Y, Tazawa R, Ishii S. Plasma globotriaosylsphingosine and α-galactosidase A activity as a combined screening biomarker for Fabry disease in a large Japanese cohort. Curr Issues Mol Biol. 2021, 43(1):389–404, DOI: 10.3390/cimb43010032.
-
Bichet DG, Aerts JM, Auray-Blais C, Maruyama H, Mehta AB, Skuban N, Krusinska E, Schiffmann R. Assessment of plasma lyso-Gb3 for clinical monitoring of treatment response in Migalastat-treated patients with Fabry disease. Genet Med. 2021, 23(1):192–201, DOI: 10.1038/s41436-020-00968-z.
-
Maruyama H, Taguchi A, Mikame M, Lu H, Tada N, Ishijima M, Kaneko H, Kawai M, Goto S, Saito A, Ohashi R, Nishikawa Y, Ishii S. Low bone mineral density due to secondary hyperparathyroidism in the GlatmTg(CAG-A4GALT) mouse model of Fabry disease. FASEB Bioadv. 2020, 2(6):365–381, DOI: 10.1096/fba.2019-00080.
-
Ishii S, Taguchi A, Okino N, Ito M, Maruyama H. Determination of globotriaosylceramide analogs in the organs of a mouse model of Fabry disease. J Biol Chem. 2020, 295(17):5577–5587, DOI: 10.1074/jbc.RA120.012665.
-
Yamashita S, Saotome M, Satoh H, Kajihara J, Mochizuki Y, Mizuno K, Nobuhara M, Miyajima K, Kumazawa A, Tominaga H, Takase H, Tawarahara K, Wakahara N, Matsunaga M, Wakabayashi Y, Matsumoto Y, Terada H, Sano M, Ohtani H, Urushida T, Hayashi H, Ishii S, Maruyama H, Maekawa Y. Plasma globotriaosylsphingosine level as a primary screening target for Fabry disease in patients with left ventricular hypertrophy. Circ J. 2019, 83(9):1901–1907, DOI: 10.1253/circj.CJ-19-0110.
-
Kitani Y, Nakagawa N, Sakamoto N, Takeuchi T, Takahashi F, Momosaki K, Nakamura K, Endo F, Maruyama H, Hasebe N. Unexpectedly high prevalence of coronary spastic angina in patients with Anderson-Fabry disease. Circ J. 2019, 83(2):481–484, DOI: 10.1253/circj.CJ-18-0734.
-
Maruyama H, Miyata K, Mikame M, Taguchi A, Guili C, Shimura M, Murayama K, Inoue T, Yamamoto S, Sugimura K, Tamita K, Kawasaki T, Kajihara J, Onishi A, Sugiyama H, Sakai T, Murata I, Oda T, Toyoda S, Hanawa K, Fujimura T, Ura S, Matsumura M, Takano H, Yamashita S, Matsukura G, Tazawa R, Shiga T, Ebato M, Satoh H, Ishii S. Effectiveness of plasma lyso-Gb3 as a biomarker for selecting high-risk patients with Fabry disease from multispecialty clinics for genetic analysis. Genet Med. 2019, 21(1):44–52, DOI: 10.1038/gim.2018.31.
-
Kinoshita N, Hosomi N, Matsushima H, Nakamori M, Yagita Y, Yamawaki T, Torii T, Kitamura T, Sueda Y, Shimomura R, Araki M, Nezu T, Aoki S, Ishii S, Maruyama H, Matsumoto M, Maruyama H. Screening for Fabry disease in Japanese patients with young-onset stroke by measuring α-Galactosidase A and globotriaosylsphingosine. J Stroke Cerebrovasc Dis. 2018, 27(12):3563–3569, DOI: 10.1016/j.jstrokecerebrovasdis.2018.08.025.
-
Maruyama H, Taguchi A, Nishikawa Y, Guili C, Mikame M, Nameta M, Yamaguchi Y, Ueno M, Imai N, Ito Y, Nakagawa T, Narita I, Ishii S. Medullary thick ascending limb impairment in the GlatmTg(CAG-A4GALT) Fabry model mice. FASEB J. 2018, 32(8):4544–4559, DOI: 10.1096/fj.201701374R.
-
Yano T, Takahashi R, Yamashita T, Nagano N, Ishikawa A, Sakurai A, Maruyama H, Miura T. Detection of urinary mulberry bodies leads to diagnosis of Fabry cardiomyopathy: a simple clue in the urine sediment. Circulation: Heart failure. 2017, 10(12):e004538, DOI: 10.1161/CIRCHEARTFAILURE.117.004538.
-
Iwafuchi Y, Maruyama H, Morioka T, Noda S, Nagata H, Oyama Y, Narita I. Enzyme replacement therapy in a patient of heterozygous Fabry disease: clinical and pathological evaluations by repeat kidney biopsy and a successful pregnancy. CEN Case Rep. 2017, 6(2):210–214, DOI: 10.1007/s13730-017-0277-y.
-
Chinen Y, Nakamura S, Yoshida T, Maruyama H, Nakamura K. A new mutation found in newborn screening for Fabry disease evaluated by plasma globotriaosylsphingosine levels. Hum Genome Var. 2017, 4:17002, DOI: 10.1038/hgv.2017.2.
-
Saito O, Kusano E, Akimoto T, Asano Y, Kitagawa T, Suzuki K, Ishige N, Akiba T, Saito A, Ishimura E, Hattori M, Hishida A, Guili C, Maruyama H, Kobayashi M, Ohashi T, Matsuda I, Eto Y. Prevalence of Fabry disease in dialysis patients: Japan Fabry disease screening study (J-FAST). Clin Exp Nephrol. 2015, 20(2):284–293, DOI: 10.1007/s10157-015-1146-7.
-
Watanabe H, Goto S, Miyashita A, Maruyama H, Wakasugi M, Yokoseki A, Kuwano R, Narita I. Role of the p.E66Q variant of GLA in the progression of chronic kidney disease. Clin Exp Nephrol. 2015, 19(2):225–230, DOI: 10.1007/s10157-014-0969-y.
-
Sakamaki Y, Maruyama H, Homma N, Nakamura G, Ito E, Makino K, Yoshita K, Ito Y, Osawa Y, Imai N, Ueno M, Miyazaki S, Narita I. The importance of medical interview with CKD patient in diagnoses of a family with Fabry disease. CEN Case Rep. 2014, 3(2):152–157, DOI: 10.1007/s13730-014-0108-3.
-
Taguchi A, Maruyama H, Nameta M, Yamamoto T, Matsuda J, Kulkarni AB, Yoshioka H, Ishii S. A symptomatic Fabry disease mouse model generated by inducing globotriaosylceramide synthesis. Biochem J. 2013, 456:373–383, DOI: 10.1042/BJ20130825.
-
Maruyama H, Takata T, Tsubata Y, Tazawa R, Goto K, Tohyama J, Narita I, Yoshioka H, Ishii S. Screening of male dialysis patients for Fabry disease by plasma globotriaosylsphingosine. Clin J Am Soc Nephrol. 2013, 8:629–636, DOI: 10.2215/CJN.08780812.
-
Nakagawa N, Maruyama H, Ishihara T, Seino U, Kawabe J, Takahashi F, Kobayashi M, Yamauchi A, Sasaki Y, Sakamoto N, Ota H, Tanabe Y, Takeuchi T, Takenaka T, Kikuchi K, Hasebe N. Clinical and genetic investigation of a Japanese family with cardiac Fabry disease Indentification of a novel α-galactosidase A missense mutation (G195V). Int Heart J. 2011, 52:308–311, DOI: 10.1536/ihj.52.308.
-
Kikumoto Y, Kai Y, Morinaga H, Iga-Murahashi M, Matsuyama M, Sasaki T, Maruyama H, Shimotori M, Makino H, Sugiyama H, Okayama A. Fabry disease exhibiting recurrent stroke and persistent inflammation. Intern Med. 2010, 49:2247–2252, DOI: 10.2169/internalmedicine.49.3724.
-
Shimotori M, Maruyama H, Nakamura G, Suyama T, Sakamoto F, Itoh M, Miyabayashi S, Ohnishi T, Sakai N, Wataya-Kaneda M, Kubota M, Takahashi T, Mori T, Tamura K, Kageyama S, Shio N, Maeba T, Yahagi H, Tanaka M, Oka M, Sugiyama H, Sugawara T, Mori N, Tsukamoto H, Tamagaki K, Tanda S, Suzuki Y, Shinonaga C, Miyazaki J, Ishii S, Gejyo F. Novel mutations of the GLA gene in Japanese patients with Fabry disease and their functional characterization by active site specific chaperone. Hum Mutat. 2008, 29:331, DOI: 10.1002/humu.9520.
-
Nakamura G, Maruyama H, Ishii S, Shimotori M, Kameda S, Kono T, Miyazaki J, Kulkarni AB, Gejyo F. Naked plasmid DNA-based α-galactosidase A gene transfer partially reduces systemic accumulation of globotriaosylceramide in Fabry mice. Mol Biotechnol. 2008, 38:109–119, DOI: 10.1007/s12033-007-9008-5.
-
Shin IS, Nishikawa K, Maruyama H, Ishii S. Histidine-tagged Shiga toxin B subunit binding assay: Simple and specific determination of Gb3 content in mammalian cells. Chem Pharm Bull. 2006, 54:522–527, DOI: 10.1248/cpb.54.522.
患者さんの笑顔につながるような成果をあげられるよう
ファブリー病の研究に取り組んでいます
当センターについて
検査のご相談
お電話またはメールフォームよりお問い合わせください。

