マウス生体内でES細胞由来肺臓器を創出 −肺疾患解明や肺再生研究へ新しい道−
新潟大学大学院医歯学総合研究科の北原哲彦(大学院生)、冉慶松(大学院生)、周啓亮助教、西條康夫教授らの研究グループは、同大学脳研究所および徳島大学との共同研究により、胚盤胞補完法 注1)を用いて肺臓器を欠損するFgf10 注2)ノックアウトマウス 注3)の生体内において、マウスES細胞に由来する肺臓器の作出に成功しました。本研究の成果は、2020年5月12日(米国東部時間)、Cell Press社の発行する科学雑誌Cell Reportsに掲載されました。
【本研究成果のポイント】
・肺臓器を欠損するFgf10ノックアウトマウスは出生後に死亡するが、胚盤胞補完法を用いてマウスの多能性幹細胞をFgf10ノックアウトマウスの胚盤胞に注入することによって肺発生が補完され、出生したキメラマウスは異常なく成体まで発育した。
・Fgf10ノックアウトマウスの胚盤胞から作成したキメラマウスの肺は実質部分のみではなく、間質部分も優位にES細胞に由来することを示した。
・Fgf10 エクソン1とエクソン3の複合ヘテロ胚盤胞を用いることにより、キメラマウスがFgf10ノックアウトマウス胚盤胞由来であることを簡便に遺伝子解析する方法を開発した。
・本研究成果は肺疾患解明のためのモデル動物開発や肺移植を目指すための肺臓器再生研究に大きく貢献するものと期待される。
Ⅰ.研究の背景
多くの重症慢性肺疾患においては肺移植しか救命の道がありません。しかし、絶対的なドナー不足のため、移植待機患者の約6割が待機中に死亡に至っているという問題があります。また、移植後の免疫拒絶及びそれに伴う合併症が術後死亡にもつながります。多能性幹細胞を用いて肺臓器の作成ができれば、上記問題の克服が可能となります。多能性幹細胞から2次元プロセスでの肺胞上皮細胞や気道上皮細胞への分化誘導法や3次元プロセスでの肺オルガノイドの作製方法、そしてバイオリアクター装置を用いた脱細胞化スキャフォールドによる肺臓器再生などの多能性幹細胞によるin vitro 肺再生研究が報告されています。しかしながら肺は複雑な3次元構造を持ち、かつ多数の細胞種からなる複雑な臓器であり、in vitro での移植に耐えうる肺臓器の再構築は極めて難しいと考えられています。胚盤胞補完法を用いて、東京大学の中内啓光特任教授らの研究グループは膵臓を欠損させたマウス/ラットの生体内において異種の多能性幹細胞に由来する膵臓を作ることに成功し、同様に腎臓の作成にも成功したことが報告されています。また、本研究とほぼ同じタイミングで肺形成に必須のFgfr2遺伝子及びβ-Catenin遺伝子のそれぞれで条件付きノックアウトマウスを作製し、胚盤胞補完法により肺の作成に成功したことも報告されています。本研究は肺臓器そのものの創出を目指し、肺発生に非常に重要であるFgf10とその主な受容体であるFgfr2シグナルに注目し、肺上皮のみならず間葉系の発生にも必須なFgf10遺伝子をノックアウトし、胚盤胞補完法を用いてマウス生体内でES細胞由来肺臓器の創出ができるのではないかと仮説を立てました。
Ⅱ.研究の概要
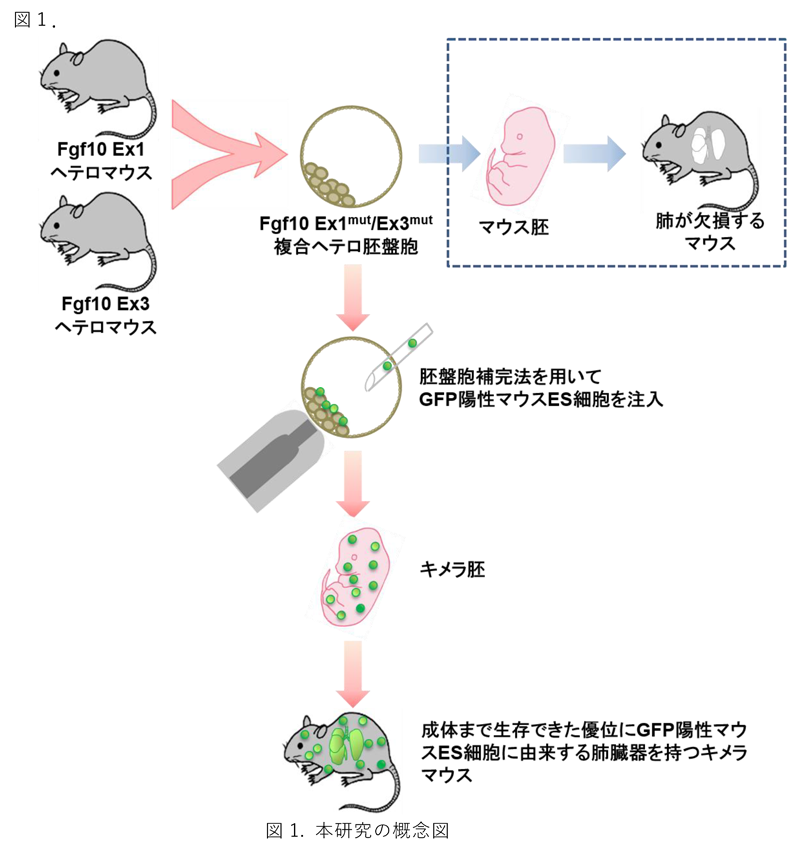
肺や四肢が欠損となるFgf10ノックアウトマウスは出生後に生存できないため、CRISPRA/Cas9システム 注4)にてエクソン1(EX1)とエクソン3(EX3)ヘテロマウスをそれぞれ作成し系統維持しました。Fgf10 Ex1ヘテロマウスとFgf10 Ex3ヘテロマウスを掛け合わせることで得られた胚盤胞において緑色蛍光タンパクであるGFP 注5)を発現するマウスES細胞(Fgf10 ワイルド)をマイクロインジェクションした後に、偽妊娠マウス子宮に着床させ、キメラ 注6)産仔を得ました。キメラ産仔及び成体まで飼育されたキメラマウスのゲノム解析、組織学的及び機能学的な解析を行い、マウス生体内にES細胞由来の肺臓器が創出されたかどうかを解析しました(図1)。
Ⅲ.研究の成果
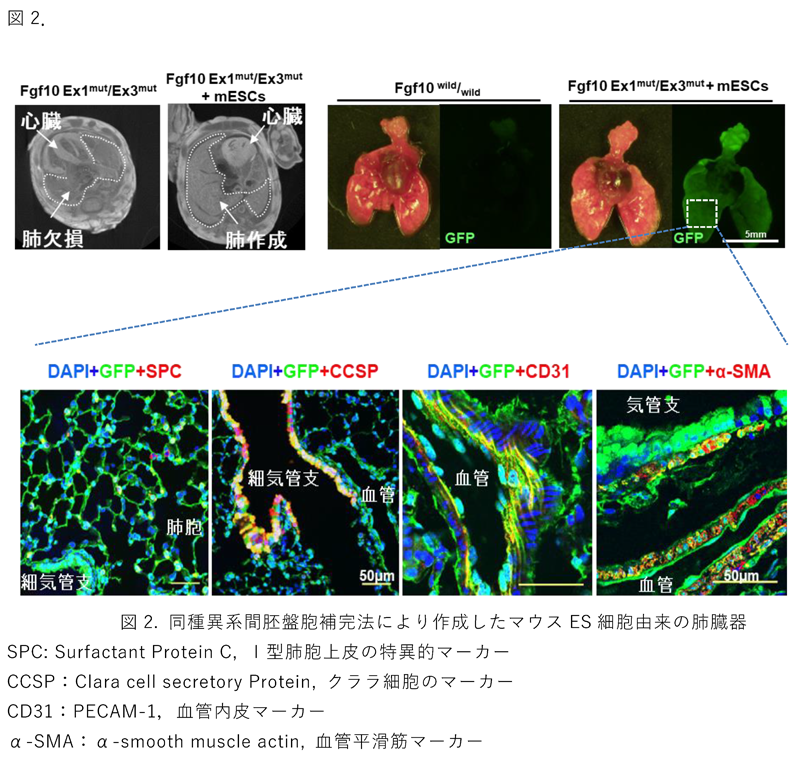
Fgf10ホモ欠損胚を使う場合には、ゲノム解析の過程で野生型ES細胞の混入よりFgf10がホモ欠失であることの証明に困難を生じるため、本研究においてはまずFgf10 Ex1mut/Ex3mut 複合ヘテロマウスを開発し、ホモ欠損と同様に肺及び四肢が欠損することを証明し、簡便かつ高効率なゲノムタイピングすることに成功しました。このFgf10 Ex1mut/Ex3mut 複合ヘテロマウス胚盤胞にGFP陽性マウスES細胞を胚操作のマイクロインジェクションで移入を行い、本来では出産後に生存できないFgf10Ex1mut/Ex3mutマウスがES細胞に補完され、成体まで異常なく発育・成熟しました。キメラ産仔及び成体キメラマウスを解析したところ、肺の実質部分(肺胞上皮細胞)が優位にGFP陽性ES細胞由来であることを確認しました。また、肺臓器の間質部分(血管内皮細胞、血管平滑筋細胞、傍気管平滑筋細胞、結合組織)においても大部分がGFP陽性ES細胞由来であることを確認しました(図2)。
Ⅳ.今後の展開
現行のFgf10 Ex1mut/Ex3mut 複合ヘテロマウスにおける胚盤胞補完法による肺臓器の創出はキメラ率とキメラリズムがまだ低いため、今後はさらなる胚盤胞補完法の改良が必要と考えます。また、Fgf10以外に肺発生に重要な遺伝子など複数の遺伝子を改変する事でより胚盤胞補完法による肺臓器再生に適切なノックアウトマウスの作製を検討します。さらにその方法を発展させ、異種間キメラでの検討や、肺疾患モデル動物の開発、大型動物における肺臓器創出技術の確立への展開が期待されます。
Ⅴ.研究成果の公表
これらの研究成果は、2020年5月12日、Cell Reports誌に掲載されました。
論文タイトル:Generation of lungs via blastocyst complementation in apneumic Fgf10-deficient mice
著者:北原 哲彦,冉 慶松,小田 佳奈子,泰江 章博,阿部 学,叶 許緑,笹岡 俊邦,土田 正則,崎村 建司,味岡 洋一,西條 康夫,周 啓亮
doi:10.1016/j.celrep.2020.107626
<用語解説>
注1) 胚盤胞補完法:特定の臓器を作る能力を欠損した動物の胚盤胞に正常な多能性幹細胞を注入することで、欠損臓器が動物生体内に完全に多能性幹細胞由来のものに置き換えられるという方法である。
注2) Fgf10:繊維芽細胞増殖因子10(Fibroblast growth factor 10, Fgf10)は主に間葉系組織から分泌され、その受容体であるFgfrに作用して肺の発生に不可欠な上皮間葉相互作用を担う分子である。Fgf10ノックアウトマウスでは、肺欠損、四肢欠損、甲状腺欠損などの発生学的に特徴のある表現型を示す。
注3) ノックアウトマウス:Knock-out mouse (ノックアウトマウス, KO mouse)は遺伝子操作によりある特定の遺伝子を欠損(無効化)させたマウスのことである。
注4) CRISPRA/Cas9システム:ゲノム上の狙った箇所を認識するRNA分子であるsingle-guide RNA(sgRNA)と核酸分解酵素であるCas9を細胞に導入することで、ゲノムDNA上の任意の領域を切断することによって遺伝子変異導入を行うシステムである。
注5) GFP:Green fluorescent protein (GFP)はオワンクラゲが持つ緑色蛍光タンパク質である。各種細胞に導入することでレポーター遺伝子として広く利用されている。
注6) キメラ:2種類以上の異なった遺伝子型の細胞、或いは異なった種の細胞によって構成された1つの個体である。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科 腫瘍内科学分野
助教 周 啓亮
E-mail:zhouql@med.niigata-u.ac.jp
教授 西條 康夫
E-mail:yasosj@med.niigata-u.ac.jp