タンパク尿発症の新たな分子機構を解明 −タンパク尿の新規治療法開発に貢献−
新潟大学大学院医歯学総合研究科腎研究センター腎分子病態学分野の河内裕教授、福住好恭准教授らの研究グループは、新潟大学脳研究所動物資源開発研究分野、新潟市民病院小児科、帝京大学内科との共同研究で、タンパク尿発症の責任部位である腎糸球体上皮細胞(注1)スリット膜(注2)の機能分子としてエフリン-B1(注3)を同定し、その機能異常によりタンパク尿が発症することを明らかにしました。タンパク尿は、腎臓病の最も重要な臨床所見であるだけでなく、脳・心血管疾患の発症にも相関していることが明らかになっていますが、タンパク尿発症の分子メカニズムは未解明で、有効な治療薬が開発されていません。本研究成果は新規タンパク尿治療法開発への貢献が期待されます。この研究成果は、Journal of the American Society of Nephrology誌(米国腎臓学会誌)(インパクトファクター:9.423)に3月31日(土)午前6時(日本時間)掲載されました。
【本研究成果のポイント】
・タンパク尿(血液中のタンパク質が尿に漏れ出てしまっている状態)の発症を防ぐバリア装置である腎糸球体上皮細胞スリット膜の分子構造の形成にエフリン-B1が重要な役割を果たしていること、エフリン-B1を欠損させたマウスはタンパク尿を発症することを明らかにした。
・エフリン-B1はスリット膜が感知した尿の状態を糸球体上皮細胞内に情報伝達するシグナル分子としての機能を果たしていることを示した。
・エフリン-B1の発現、分子機能の制御による新規タンパク尿治療法の開発が期待される。
Ⅰ.研究の背景
慢性腎臓病(注4)の総患者数は、約1,300万人と推定されており、新たな国民病と捉えられています。腎臓の主な役割は尿を作ることです。腎臓は、人が生きていくために行われる代謝で生じた老廃物を尿として排泄する一方で、身体に必要なタンパク質を尿中に漏らさないようにしています。このための濾過装置が糸球体と呼ばれる構造物です。タンパク尿はこの濾過装置のバリア機能が低下し血液中のタンパク質が尿中に漏れ出てしまっている状態です。タンパク尿は、腎臓病の濾過装置の傷害を示す最も重要な臨床所見であり、タンパク尿自体が腎臓病をさらに進行させる悪化因子であることが明らかになっています。また、タンパク尿を示す人は、脳卒中や心血管疾患の発症率が約3倍であるとする統計学的な検討結果が報告されており、タンパク尿は、これら生命予後に重大な影響を与える他臓器疾患の発症にも関連していることが明らかになっています。
新潟大学腎研究センター腎分子病態学分野の研究グループは、糸球体上皮細胞の細胞間に存在するスリット膜という構造物が、タンパク質が尿中に漏れ出ないようにしている最終バリアであることを世界に先駆けて明らかにしました。スリット膜は小さな孔を持つ格子状の構造をしています。老廃物は小さい分子のためこの格子構造の孔を通過しますが、分子径の大きいタンパク質はこの孔を通れません。腎臓病の患者さんでは、この格子構造に異常が起こり、孔が大きくなり、タンパク質が尿中に漏れ出てしまいます。この状態がタンパク尿です。スリット膜のこの格子構造がどのような分子で形成されているのでしょうか?その詳細は現在も不明です。また、どのような機序でこの分子構造が変化してタンパク尿が発症するのか?ということについてはまだほどんど分かっていないというのが現状です。そのため、タンパク尿に対する有効な治療法が確立されていません。
Ⅱ.研究の概要
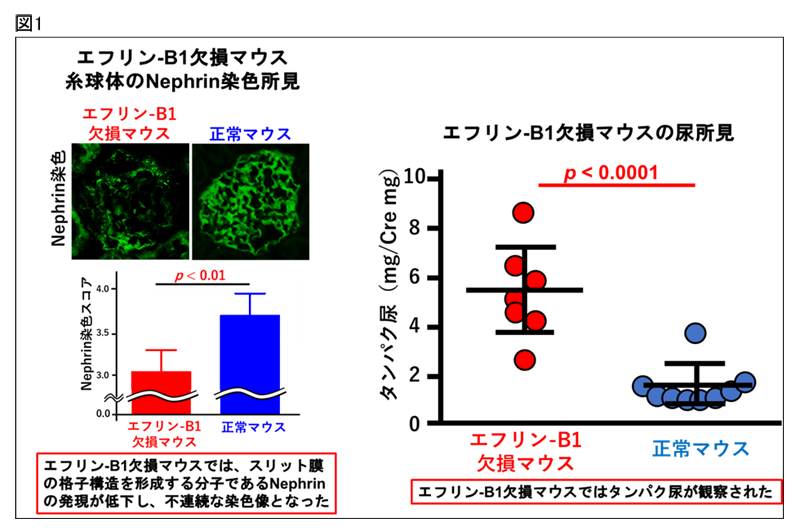
スリット膜の格子構造の中心部は、Nephrinと呼ばれる分子量18万ダルトンの大きい分子が重なりあって形成されていることが報告されていましたが、一定の大きさの孔をもつ頑丈な格子構造を維持するための分子構造の詳細は不明でした。これまでの研究で、エフリン-B1がスリット膜に発現していること、タンパク尿を呈する病態で発現が低下していることを報告してきました。本研究では、スリット膜におけるエフリン-B1の発現を随時に低下させることができる遺伝子改変マウスを開発し、スリット膜におけるエフリン-B1の機能を解析しました。スリット膜の分子構造の維持にエフリン-B1が重要な役割を果たしていること(図1左)、エフリン-B1を欠損させたマウスはタンパク尿を発症すること(図1右)を明らかにしました。
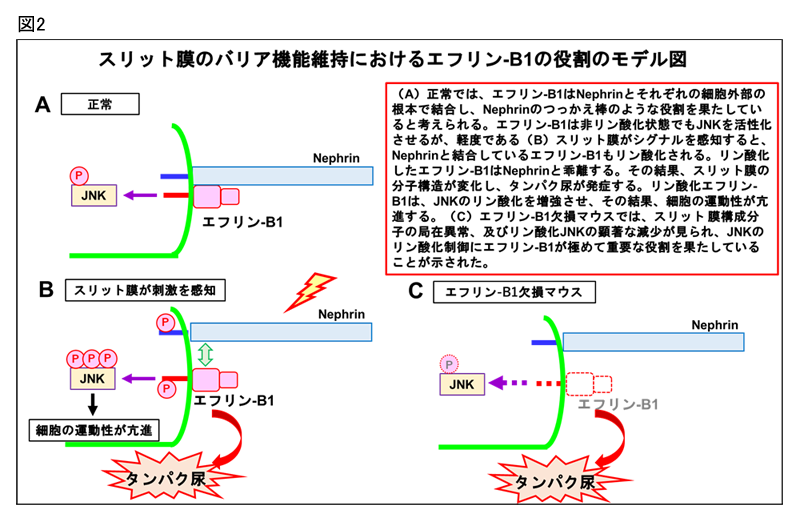
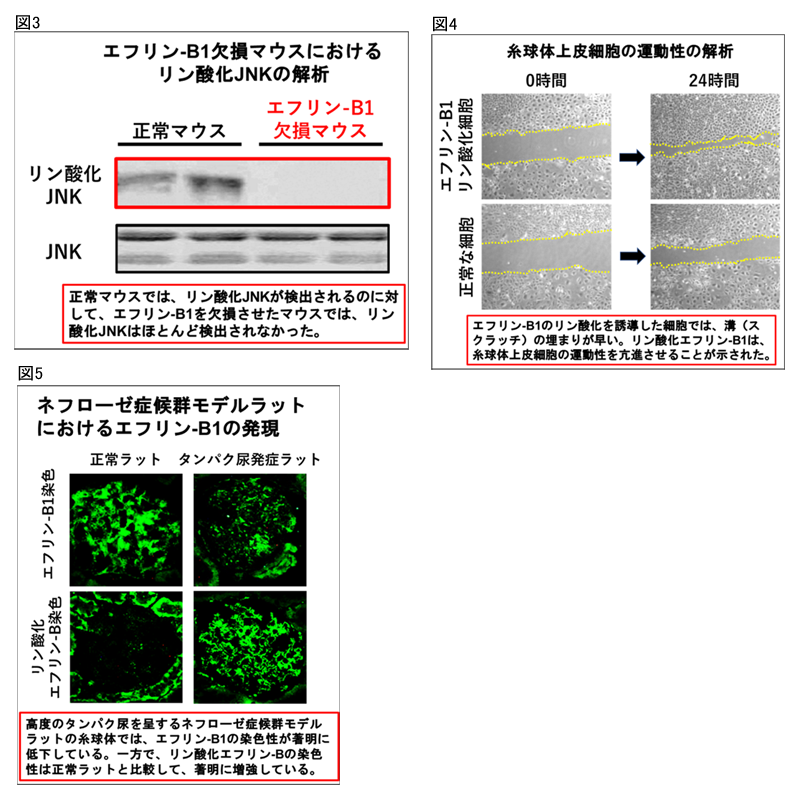
エフリン-B1とNephrinはともに細胞膜を1回貫通して細胞外に突き出た細胞膜分子ですが、エフリン-B1は分子量4万ダルトンの比較的小さい分子です。本研究では、エフリン-B1とNephrinの結合様式を詳細に解析し、エフリン-B1は、Nephrin分子を根元で支えるような形で結合していることを明らかにしました(図2-A)。さらに、Nephrin分子が抗体などで刺激されると、Nephrinと結合しているエフリン-B1がリン酸化(注5)されます。リン酸化されたエフリン-B1はNephrinとの結合性が低下し、スリット膜の分子構造が変化し、タンパク尿が発症することを示しました(図2-B)。エフリン-B1を欠損したマウスでは、スリット膜の精緻な分子構造が形成されないため、タンパク尿が発症すると考えられます(図2-C)。また。リン酸化されたエフリン-B1はJNKシグナル(注6)を活性化させること、また、エフリン-B1を欠損したマウスでは、JNKシグナルの活性化が顕著に低下することを発見し、エフリン-B1が糸球体でのJNKシグナルを制御していることを明らかにしました(図3)。さらに、リン酸化エフリン-B1により下流のJNKシグナルが活性化されると細胞の運動性が亢進することを発見しました(図4)。糸球体上皮細胞の運動性が亢進すると糸球体が不安定になり、一定の孔を持つスリット膜構造の維持が難しくなり、さらに重篤なタンパク尿を引き起こすと考えられます。本研究では、ネフローゼ症候群(注7)の症例、ラットのネフローゼ症候群モデルでは、エフリン-B1の発現が低下し、残っているエフリン-B1がリン酸化していることを発見しました(図5)。エフリン-B1の発現、機能異常によりタンパク尿が発症する新たな分子機構を発見しました。
Ⅲ.研究の成果
・タンパク尿の発症を防ぐバリア装置である腎糸球体上皮細胞スリット膜の分子構造の維持にエフリン-B1が重要な役割を果たしていること、エフリン-B1の発現低下、機能異常によりタンパク尿が発症することを発見しました。
・エフリン-B1はスリット膜が感知した細胞外の情報を細胞内に伝えるシグナル伝達分子としての役割を果たしていることを発見しました。
・ネフローゼ症候群の症例でエフリン-B1の発現が低下していることを発見しました。
Ⅳ.今後の展開
本研究は、スリット膜のバリア機能維持におけるエフリン-B1の役割を解明し、タンパク尿発症の新たな分子機構を明らかにしました。エフリン-B1の発現低下の抑制、リン酸化抑制、JNK活性を制御する薬剤、化合物がタンパク尿治療薬として有効である可能性を示しました。今後、既存の薬剤、新規化合物での検討を行い、タンパク尿の新規治療薬の開発を目指します。
<用語解説>
(注1)腎糸球体上皮細胞:
糸球体を構成する3種の細胞の1つで、糸球体の最外層に位置し、糸球体の形態の維持、糸球体のバリア機能の維持において最も重要な役割を果たしている細胞。神経細胞や心筋細胞と同様、生体内で最も分化した細胞の1つで増殖能を持たない。
(注2)スリット膜:
糸球体上皮細胞間に存在する細胞間接着装置。血液中のタンパク質が尿中に漏れ出るのを防ぐ最終バリアとしての役割を果たしている。多くの腎疾患におけるタンパク尿は、スリット膜のバリア機能の障害により発症すると考えられている。
(注3)エフリン-B1:
1回膜貫通型の細胞膜分子。全身の多くの細胞で発現している。神経細胞や心筋細胞でエフリン-B1を欠損させたマウスでは、神経ネットワーク形成の異常、心臓の血管構築の異常が起こる。
(注4)慢性腎臓病:
腎の濾過機能を示す数値が60%以下になった状態、もしくは持続性のタンパク尿が確認されると慢性腎臓病と診断される。国内の総患者数は1,300万人と推定されている。慢性腎不全(腎機能が低下し、血液透析療法、腎移植が必要となる状態)の予備軍と考えられている。
(注5)リン酸化:
タンパク質の機能を変化させる化学反応(機能修飾)の1つ。タンパク質はリン酸化すると立体構造が変化し、多くの場合、機能が活性化する。活性化されたタンパク質は、他のタンパク質を活性化、あるいは不活性化させる。また、他のタンパク質と結合する、あるいは解離するなど多種多様な方法で細胞内にシグナルを伝達させる。
(注6)JNKシグナル:
細胞外からの様々なストレス刺激や細胞内のシグナルを核へ伝達するための主要な細胞なシグナル伝達システムの1つ。JNKは上流の活性化因子によりリン酸化されると活性化し、下流のタンパク質をリン酸化させる。核内に情報を伝え、遺伝子発現を調節することにより、アポトーシス、細胞運動などの細胞応答を誘導する。
(注7)ネフローゼ症候群:
高度なタンパク尿を示す病態。持続的なタンパク尿により血液中のタンパク質が低下するため、全身性の浮腫、感染に対する抵抗力の低下などの症状を呈する。
Ⅴ.研究成果の公表
これらの研究成果は、Journal of the American Society of Nephrology誌(米国腎臓学会誌)(インパクトファクター: 9.423)のオンライン版に平成30年3月31日(土)午前6時(日本時間)掲載されました。
論文タイトル:Nephrin-binding ephrin-B1 at slit diaphragm controls podocyte functions through JNK pathway
著者:Yoshiyasu Fukusumi¹, Ying Zhang¹, Ryohei Yamagishi¹, Kanako Oda², Toru Watanabe³, Katsuyuki Matsui⁴ & Hiroshi Kawachi¹*
1) Department of Cell Biology, Kidney Research Center, Niigata University Graduate School of Medical and Dental Sciences
2) Department of Comparative and Experimental Medicine, Brain Research Institute, Niigata University, Niigata, Japan
3) Department of Pediatrics, Niigata City General Hospital, Niigata, Japan
4) Department of Internal Medicine IV, Teikyo University School of Medicine, Kawasaki, Japan
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科
腎研究センター 腎分子病態学分野
教授 河内 裕
E-mail:kawachi@med.niigata-u.ac.jp