糖尿病性神経障害発症における細胞外基質の役割を解明 −コンドロイチン硫酸の発現調節による症状軽減化と新たな治療戦略への期待−
新潟大学大学院医歯学総合研究科神経生化学分野の五十嵐道弘教授(研究当時)、同研究科血液・内分泌・代謝内科学分野の石黒創特任助教らの研究グループは、糖尿病の合併症である糖尿病性神経障害のモデル動物の性質を調べて、細胞外基質(注1)のコンドロイチン硫酸(CS)(注2)が、糖尿病性神経障害において、細胞間での情報伝達を仲介する重要な役割を果たしていることを世界で初めて解明しました。
糖尿病性神経障害を発症したマウスにおいて、通常では血糖値(注3)が上昇すると、TGF-β(注4)と呼ばれる、炎症を増悪させる細胞間の情報伝達因子のシグナルが上昇するのに対し、CSを減少させた場合、血糖値を高めてもTGF-βが変動しないことを証明しました。またその結果、神経障害の程度が大きく軽減することを見出しました。本研究成果は、今後の糖尿病性神経障害の病態解明や新規の創薬につながるものと期待されます。
(この成果は、新潟大学大学院医歯学総合研究科・神経生化学分野、同研究科血液・内分泌・代謝内科学分野、同研究科薬理学分野、医学部メディカルAIセンター;神戸薬科大学、東京都医学総合研究所との共同研究です。)
【本研究成果のポイント】
・CSを減少させたマウスでは、糖尿病性神経障害の症状が減弱する。
・CSを減少させたマウスでは、糖尿病モデルで問題視される、ぺリサイト(注5)の脆弱性が軽減する。
・通常のマウスではTGF-βのシグナル伝達が高血糖で活性化するが、CSを減少させたマウスではTGF-βのシグナル伝達が高血糖の前後で変化しない。
Ⅰ.研究の背景
糖尿病は、日本では潜在的患者数を含めて2千万人いるとも言われる生活習慣病です。その恐ろしさは高血糖が持続することによる血管障害の様々な合併症が生ずることで、患者のQOLを下げ、大きな社会問題となっていると言えます。中でも糖尿病性神経障害は末梢神経障害の中で圧倒的に患者数が多く、糖尿病の比較的初期の段階から発症し、感覚鈍麻(手足の感覚が鈍くなること)や異常感覚(しびれ感などの不快な感覚)などの症状が患者を苦しめています。しかし、現在も血糖値のコントロール以外に、有効な薬物治療などがありません。他の合併症では、腎症の人工透析や網膜症のレーザー治療などの治療法が開発されている点からも、新しい治療法の戦略が望まれているところです。
糖尿病性神経障害の難治性の理由の一つは、その発症機序や増悪のメカニズムについて多くの研究がなされてきたにも関わらず、よくわかっていない点にあります。これまで糖尿病性神経障害は、神経細胞が高血糖にさらされたとき、細胞の中でどのような代謝の変化が起こるかを中心に研究が進められてきましたが、本研究グループは、「細胞間での高血糖に基づく情報伝達の変化」に深くかかわる細胞外基質の役割を研究することにしました。細胞外基質は、細胞同士の間に介在する、細胞間がやり取りする情報伝達を仲介・介助する役割の構造です。その中でもCSという糖鎖に着目しました。
Ⅱ.研究の概要
CSは軟骨・関節などに多く存在しますが、実は全身の細胞外基質の主要成分で、どの臓器にも存在しています。2010年に五十嵐教授の研究グループは、この合成経路の中で最も重要(律速段階)と考えられる糖転移酵素CSGalNAcT1(T1)が働かないマウス(T1KO)を作成し、このマウスで様々なヒト病態のモデルを作成すると、著しく症状が軽減することを見出しました(例えば、脊髄損傷の回復が起こること(Nature Communications 2013)、多発性硬化症という脳の病気の症状がかなり軽くなること(Glycobiology 2021)など)。このマウスは様々な解析から、どの臓器でもCS量が大体1/3から1/2程度は減少することが知られています(他にも多数の酵素がCS合成に関係しているため、T1のみを欠損させてもCS量は0にはならず、成育途中で死亡したりはしません)。T1KOを高血糖状態にしたところ、血糖値は高いにもかかわらず、通常のマウス(野生型マウス; WT)に比較して神経障害の症状が著しく軽減することを見出しました(下図=概要図;WTとT1KOでの高血糖時の神経障害の違いと、今回解明されたその原理)。そこで起こっている変化を様々な方法で調べたところ、細胞間で炎症の情報伝達に関わるTGF-βシグナルが抑制されていることが症状軽減につながっていることを発見しました。
Ⅲ.研究の成果
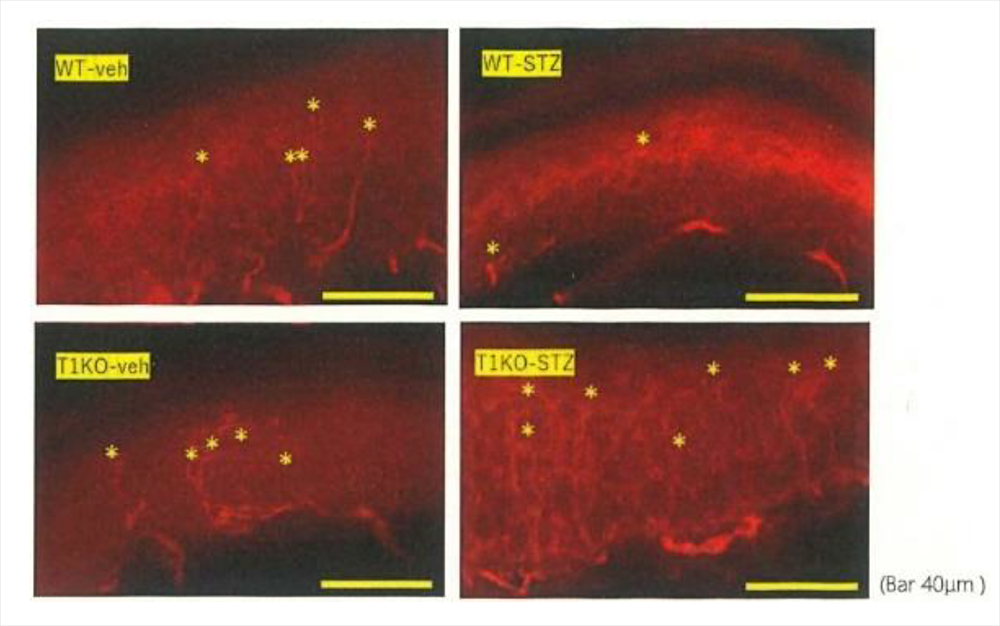
T1KOとWTそれぞれに高血糖を生じさせると、WTでは手足の感覚の低下が起こるのに対し、T1KOでは感覚の変化が起こりません。感覚を司る神経の様子を調べると、WTでは神経伝導速度(神経で電気信号が伝わるスピード)が低下し、かつ神経の変性が起こり、正常な神経の残存数がかなり少なくなっていました。一方、T1KOでは神経伝導速度は正常で、かつ神経の数はWTと全く変わりません。神経再生現象を表すGAP-43というタンパク質のリン酸化抗体で確認しても変化が見られないので、T1KOの神経は、高血糖にさらされても壊れにくい状態にあることが分かりました(図=下図;残存神経(星印)の状態。高血糖状態のWT(WT-STZ)は正常な状態のWT(WT-Veh)に比べ、残存神経がかなり少ないが、高血糖状態のT1KO(T1KO-STZ)は高血糖状態なのに残存神経が多い)。
さらにT1KOでは出生直後の網膜の血管系を用いた実験系で、ペリサイトが血小板由来成長因子PDGFの受容体(PDGFRβ)に対する抗体に、WTと比較して著しく抵抗性であり、血管と神経系の相互作用がより安定と考えられる結果を得ました。ヒトの糖尿病合併症は血管の障害が主たる誘因と思われるため、この結果から細胞間の相互作用が想起されます。
CS量が減少することで、T1KOでは高血糖時に細胞死を誘発する遺伝子の発現が有意に低く、WTでは高血糖で働く遺伝子が働きにくくなることが想定されました。しかし、これまで糖尿病性神経障害の病態モデルで報告されていた遺伝子の変化がほとんどなく、どのような仕組みでこの変化がWTで起き、T1KOでは抑えられるのか、なかなか分かりませんでした。
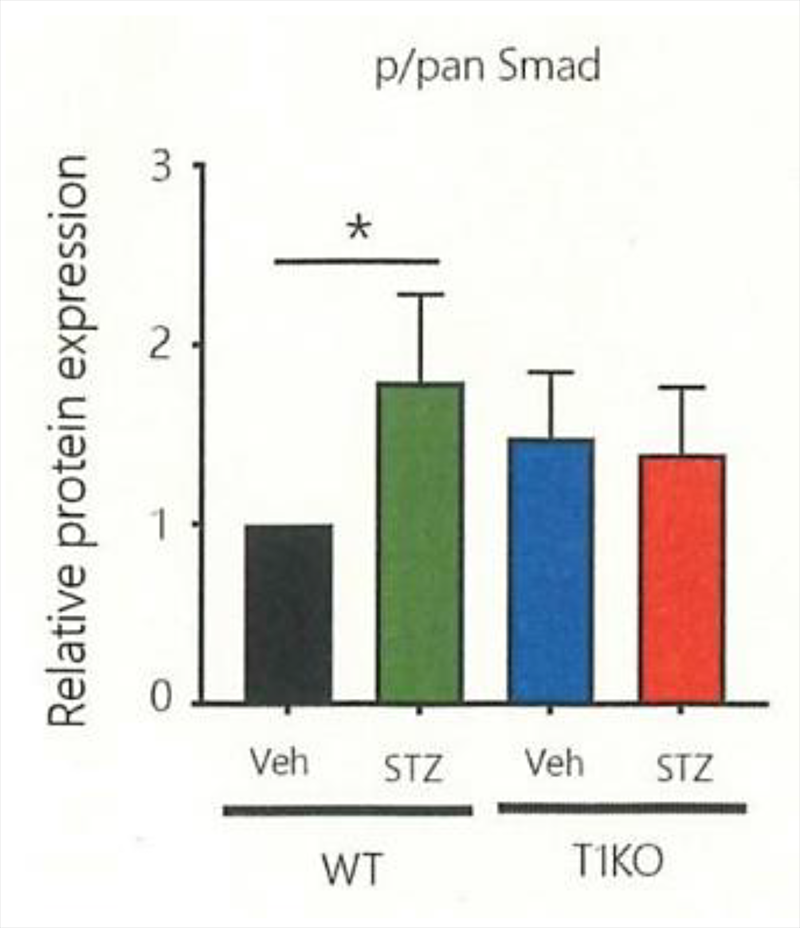
そこでRNA-seq(注6)という方法を使って、発現する遺伝子群の変化を網羅的に比較してその特徴を感覚鈍麻の現れ方と比較したところ、TGF-βという炎症の時に働く因子の受容体の発現がWTの高血糖群では上昇しており、T1KOでは全く変化していないことを見出しました。この因子が働いていると、Smad2/3というタンパク質のリン酸化(注7)が細胞内で生ずるため、このリン酸化状態の変動を調べると、WTでは高血糖になると正常時に比べて急速にリン酸化が増大して変化の比率が大きくなりますが、T1KOでは変化の比率が小さいことが分かり、TGF-βの働きが弱まっていることが明確になりました。よって、通常は高血糖で作動する炎症シグナルTGF-βが神経細胞にダメージを与えて糖尿病性神経障害の発症・増悪に寄与するところが、細胞外基質のCS合成量が低下していると、細胞間でのTGF-βの働きが減弱して神経へのダメージが生じにくくなることが明らかになりました。
Ⅳ.今後の展開
血管系と神経系の相互作用を含めて、このマウスモデルにおいては、糖尿病性神経障害を引き起こし、それを増悪させるTGF-βのシグナル伝達が、CS及び、それが存在している細胞外基質部分で調節されていることが明らかとなり、CSの量が減っているT1KOではこの反応が非常に起こりにくくなっていることが示されました。これは糖尿病性神経障害に関して、これまでは全く不明であった細胞間のコミュケーションを介する病気の成り立ちを、初めて示唆するものと考えられます。
一方、糖尿病性神経障害の患者ではまだこの点が明らかになっていません。今後は糖尿病性神経障害の患者に同様の成り立ちが考えられるかどうかの証拠を集める必要があると思われます。仮にマウスモデルと共通性のある変化が見出された場合には、それをもとに診断・治療の開発ができる可能性があります。ごく初期の変化を捉える鋭敏な診断法や、新たな治療戦略に基づいた創薬、化合物の発見、といった可能性が考えられ、長い道のりではありますが、糖尿病性神経障害を克服できる第一歩がこの研究から生まれることが期待されます。
Ⅴ.研究成果の公表
本研究成果は、2024年4月12日13時(米国東部時間)、科学誌「iScience」に掲載されました。
論文タイトル:Reduced chondroitin sulfate content prevents diabetic neuropathy through TGF-β signaling suppression
著者:Ishiguro H, *Ushiki T, Honda A, Yoshimatsu Y, Ohashi R, Okuda S, Kawasaki A, Cho K, Tamura S, Suwabe T, Katagiri T, Ling Y, Iijima A, Mikami T, Kitagawa H, Uemura A, Sango K, Masuko M, *Igarashi M, Sone H
doi: 10.1016/j.isci.2024.109528
Ⅵ.謝辞
本研究は、文部科学省科学研究費助成事業(課題番号#19K18001、#21K11671、#15K19547、#19K11716)、#16K09168、#22K19392、#18H04013、#20H03597)、日本医療研究開発機構(#19gm1210007s0101、#20gm1210007s0102、#21gm1210007s0103、#22gm1210007s0104、#23gm1210007s0105)、日本血液学会研究助成金、小林研究財団助成金、先端動物プラットフォーム支援事業の支援を受けて行われました。
【用語解説】
(注1)細胞外基質:細胞と細胞の隙間を埋めている物質グループを言います。細胞と細胞の間には、何も存在しないのではなく、多数の物質が存在しています。例えば、コラーゲンなどの結合組織と呼ばれている構造の構成成分は、細胞間の構造を強化していると考えられています。一方、それ以外の重要な役割として、細胞外基質は、細胞と細胞の情報伝達を仲介していると考えられ、その証拠がたくさんわかってきており、現在も病気の進行に関与する、重要なカギとして様々な医学研究でフォーカスされています。
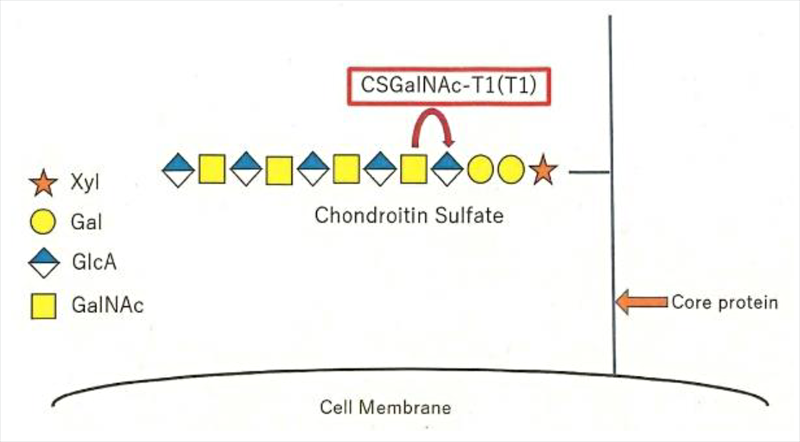
(注2)コンドロイチン硫酸(CS):細胞外基質の一つで、長い糖鎖をもつ酸性の物質です(図=下図;CSの構造模式図(硫酸基は省略されているが、実際にはCSの長い糖鎖に多数結合している)。この物質は負の電荷を多く持つため、正の電荷をもつ物質(塩基性の物質;例えばTGF-βなど)と結合し、相互作用しやすいと考えられ、数多くの細胞間コミュニケーションを仲介できる、マスター因子の一つと想定されています。一方で、構造に多様性があり、まだタンパク質などに比べると研究の大きな発展はこれからと考えられています。
(注3)血糖値:血液中のグルコース(ブドウ糖)の値のことで、ヒトを含む哺乳動物では脳へのエネルギー供給の中心となるため、きわめて重要視されています。血糖値が恒常的に上昇している状態が糖尿病で、この状態が血管を傷つけるため、ヒトでの生活習慣病としてその対策が急がれています。
(注4)TGF-β:細胞間の情報伝達を担う液性因子の一つで、PDGF-βなどと同様、正常及び病態で産生の程度は変化します。TGF-βは多数の類縁分子があり、その受容体(特異的に結6合してシグナル伝達を開始させるタンパク質)も多様性があります。特にいろいろな臓器の病態で、炎症を引き起こすことが知られており、がんの進展にも関係しています。
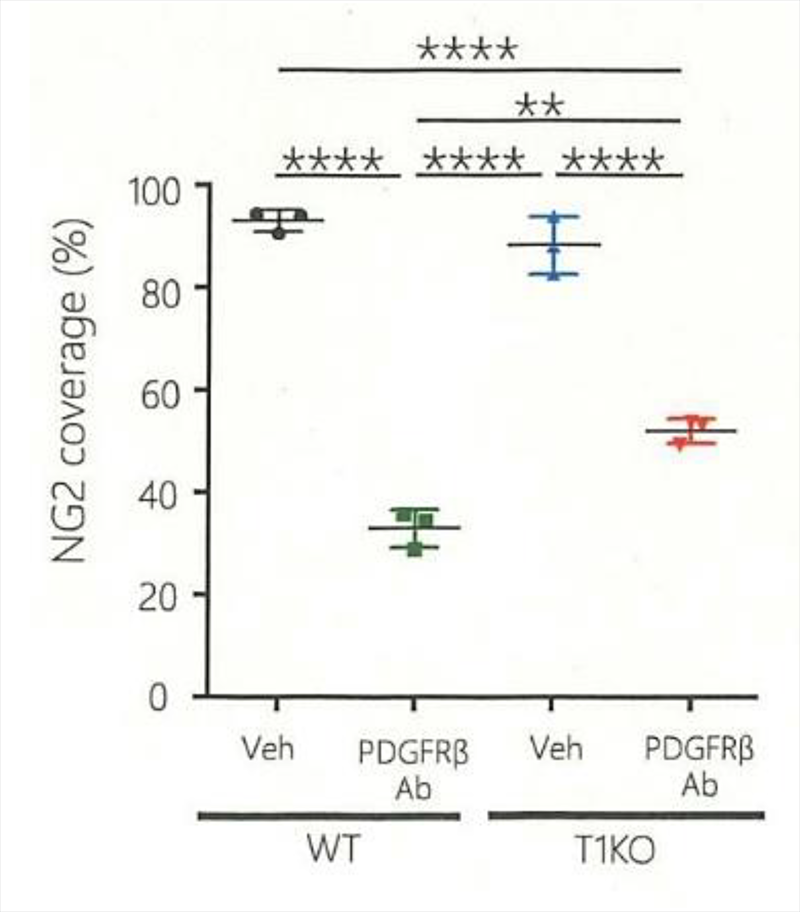
(注5)ぺリサイト:血管周皮細胞のことで、血管を構成する重要な細胞の一つです。特に最近、脳血管のぺリサイトの研究から、ぺリサイトは血管とそれに栄養される細胞との間で、バリア機能(特定の物質だけを血管から細胞に供給し、それ以外は取り込まれないようにする機能)を持っている重要な細胞であることが見出されました。ペリサイトはNG2というタンパク質を発現していますが、T1KOでPDGFRβ抗体を投与しても、WTよりNG2の残存がかなり多く、ペリサイトが残っていると考えられます(図=下図;PDGFRβ抗体投与後の、ペリサイト量の確認)。
(注6)RNA-seq:RNA-sequenceの略で、細胞内で発現している遺伝情報(mRNA)の塩基配列を、網羅的に次世代シークエンサーで読み取って解析する手法。最近、高速での解析が進み、また情報分析のコンピューターサイエンス(バイオインフォマティクス)が進歩したため、現代の医学研究に必要不可欠の方法論となっています。微量な変化も正確に読み取れるため、これまでほかの方法論では捉えられなかった、ある病態に特徴的な変化を見出すことができるようになりました。
(注7)タンパク質のリン酸化:タンパク質の特定のアミノ酸に、細胞への刺激などに伴ってリン酸が結合する反応で、負の電荷が増えるため、タンパク質の性質が大きく変わり、シグナル伝達の効率を大きく増強または抑制することに使われます。またリン酸化の変化が証明されると、そのタンパク質の関係するシグナル伝達効率の変化の可能性が想定され、研究を進めることができます(図=下図;T1KOの高血糖(STZ)条件でも、WTに比べてリン酸化Smad2/3分子の量が少なく、活性化の程度が弱いと判断される)。
本件に関するお問い合わせ先
【研究に関すること】
1) 新潟大学大学院医歯学総合研究科 神経生化学分野
前教授(客員研究員) 五十嵐 道弘(いがらし みちひろ)
E-mail:tarokaja@med.niigata-u.ac.jp
2) 新潟大学大学院医歯学総合研究科 血液・内分泌・代謝内科学
特任助教 石黒 創(いしぐろ はじめ)
E-mail:power@med.niigata-u.ac.jp
【広報担当】
新潟大学医歯学系総務課
E-mail:shomu@med.niigata-u.ac.jp