内耳特殊体液「内リンパ液」の解析 (研究内容にもどる)
【研究内容の概略】
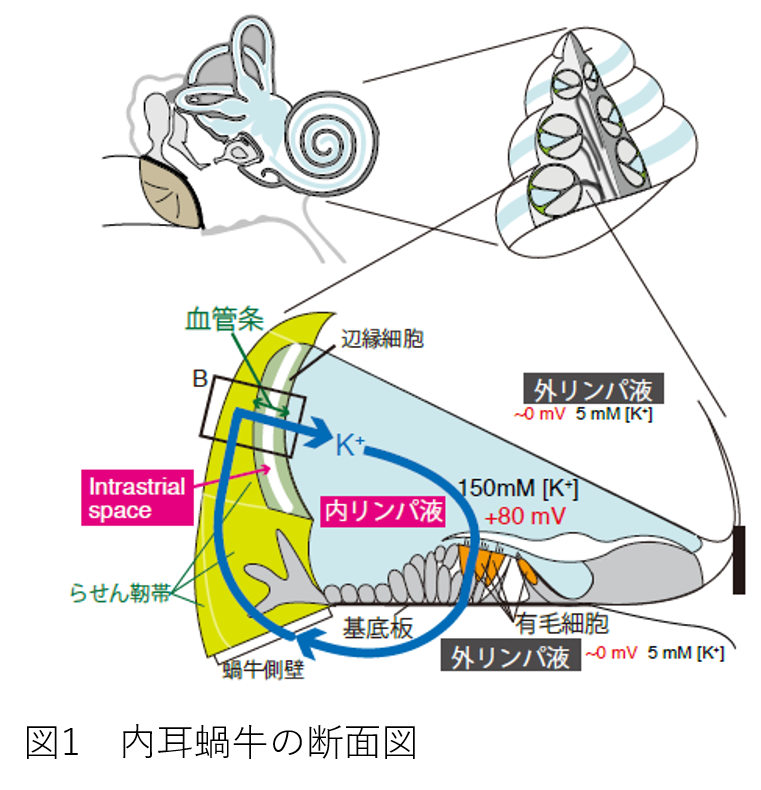 もう一度、内耳が働く仕組みを簡単にご説明します。図1は、三つの管から成る蝸牛の断面図です。上下二つの管は、通常の細胞外液や血液と類似の「外リンパ液」を含んでいます。一方、中央の管には、「内リンパ液」と呼ばれる特殊な体液が満たされています。 これは、細胞外液であるにも関わらず、150 mMの高K+(カリウムイオン)と2 mMの低Na+(ナトリウムイオン)を含みます。まるで、細胞内の環境のようです。 しかも、内リンパ液は、外リンパ液を基準とすると、常に+80 ~ +100 mVの高電位を示します。このような特殊な電位・イオン環境は、有毛細胞の鋭敏な働きや聴覚の高い感受性に必須であり、破綻すると難聴が起こります。
もう一度、内耳が働く仕組みを簡単にご説明します。図1は、三つの管から成る蝸牛の断面図です。上下二つの管は、通常の細胞外液や血液と類似の「外リンパ液」を含んでいます。一方、中央の管には、「内リンパ液」と呼ばれる特殊な体液が満たされています。 これは、細胞外液であるにも関わらず、150 mMの高K+(カリウムイオン)と2 mMの低Na+(ナトリウムイオン)を含みます。まるで、細胞内の環境のようです。 しかも、内リンパ液は、外リンパ液を基準とすると、常に+80 ~ +100 mVの高電位を示します。このような特殊な電位・イオン環境は、有毛細胞の鋭敏な働きや聴覚の高い感受性に必須であり、破綻すると難聴が起こります。
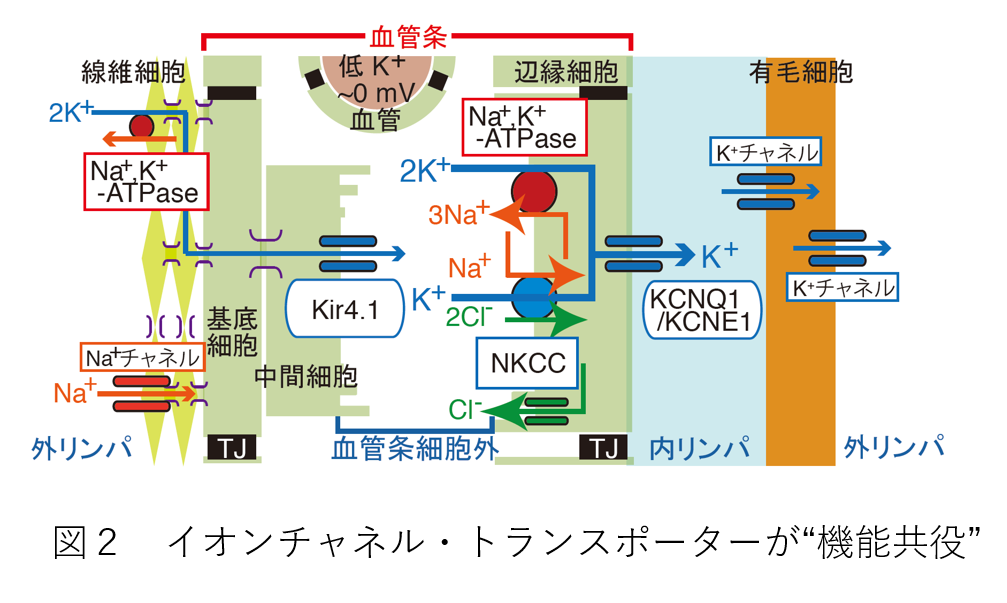
以前より、内リンパ液の環境の維持には、この体液と外リンパ液の間のK+の循環が重要な役割を果たしていると指摘されてきました。 この一方向性のイオン輸送は、内層・外層の2層から構成される上皮様組織 “側壁”により駆動されると考えられています。しかし、内リンパ液とK+循環の実際の関係は、詳細にわかっていませんでした。 わたしたちは、内リンパ液の高電位に着目し、その成り立ちとK+循環との関係を長年に渡って研究してきました。 そして、他グループの研究成果も合わせると、(1)おおよそ図2に示すようなイオンチャネル・トランスポーターが“機能共役”することでK+が円滑に循環すること、(2)側壁には二つの“濃淡電池”が直列につながっており、これらがK+循環によって綿密に調節されること、(3)これら(1)と(2)の結果により、内リンパ液に高電位が現れることが、徐々に分かってきました(成果4-11)。
また、このK+循環に関わる重要要素を光遺伝学の手法で障害させると、突発性難聴のように瞬時に聴力低下が誘引される病態が再現できました(成果3)。
 現在、様々な周波数や大きさの音が入った時の反応の調査や様々な病的状態の時の解析に取り組み始めています。また、内リンパ液の物性にも興味を持ち、その精密測定を目的として理工系の研究者と協働し新たな方法論を取り入れようとしています。
現在、様々な周波数や大きさの音が入った時の反応の調査や様々な病的状態の時の解析に取り組み始めています。また、内リンパ液の物性にも興味を持ち、その精密測定を目的として理工系の研究者と協働し新たな方法論を取り入れようとしています。
【実験手法】
実験装置の外見などは、計測機器のページをご覧ください。
(1)分子生物学的手法・組織学的手法:K+循環に関与するチャネルやトランスポーターを分子同定し、その局在を知るために使います(成果3, 4, 12)。
(2)網羅的解析:HPLCやLC-MS/MSなどの最新機器を使い、K+循環に関与する分子を網羅的に同定しています。大阪大学大学院医学系研究科の金井好克教授・永森收志先生(現 奈良県立医科大学教授)との共同研究です(成果13)。
(3)イオン電極法:K+循環は、側壁のイオン濃度を制御することで内リンパ液の電位を維持します。従って、この組織の細胞内外のK+濃度動態を調べることは、とても重要です。
わたしたちは、その場のK+濃度と電位を同時にモニターする「イオン電極」を、in vivo計測に活用します。現在、蝸牛を対象にこの技術を駆使できるのは、世界でも恐らくわたしたちのみです(成果4-10)。
(4)コンピュータシミュレーション:生命現象には、実験では測れないパラメータがあります。 例えば、本研究に関しては、チャネルやトランスポーターを介した各イオンの流れを直接的に捉えることはできません。
計算科学は、理論的背景に立って、この問題を解決してくれます。わたしたちは、側壁に分布するチャネルやトランスポーターの働きに基づき数式を立て、有毛細胞のイオン流と統合した数理モデル「Nin-Hibino-Kurachi(NHK)モデル」を2012年に発表しました(成果9)。
その後の実験結果に基づき、最近、モデルを更新しました(fi-NHKモデル;ソースコード)(成果4)。初期のモデルでは達成できなかった計測値を再現し、その成り立ちをシミュレーションできます。引き続き、多彩な局面でモデルを改良・活用していく予定です。
【この研究に関する主な成果】
(1) Nonomura Y, Sawamura S, Hanzawa K, Nishikaze T, Sekiya S, Higuchi T, Nin F, Uetsuka S, Inohara H, Okuda S, Miyoshi E, Horii A, Takahashi S, Natsuka S, Hibino H.
Characterisation of N-glycans in
the epithelial-like tissue of the rat
cochlea. Scientific Reports, (2019), 9, Article number:1551.
(2) Watabe T, Xu M, Watanabe M, Nabekura J, Higuchi T, Hori K, Sato MP, Nin
F, Hibino H, Ogawa K, Masuda M, Tanaka KF. Time-controllable Nkcc1 knockdown
replicates reversible hearing loss in postnatal mice. Scientific Reports, (2017), 7, Article number:13605.
(3) Sato MP, Higuchi T, Nin F, Ogata G, Sawamura S, Yoshida T, Ota T, Hori K, Komune S, Uetsuka S, Choi S, Masuda M, Watabe T, Kanzaki S, Ogawa K, Inohara H, Sakamoto S, Takebayashi H, Doi K, Tanaka KF, Hibino H. Hearing loss controlled by optogenetic stimulation of nonexcitable nonglial cells in the cochlea of the inner ear. Frontiers in Molecular Neuroscience, (2017), 10(300): 1-16.
(4) Nin F, Yoshida T, Murakami S, Ogata G, Uetsuka S, Choi S, Doi K, Sawamura S, Inohara H, Komune S, Kurachi Y, Hibino H. Computer modeling defines the system driving a constant current crucial for homeostasis in the mammalian cochlea by integrating unique ion transports. npj Systems Biology and Applications, (2017), 3, Article number:24.
(5) Yoshida T, Nin F, Murakami S, Ogata G, Uetsuka S, Choi S, Nakagawa T, Inohara
H, Komune S, Kurachi Y, Hibino H. The unique ion permeability profile of
cochlear fibrocytes and its contribution to establishing their positive
resting membrane potential. Pflügers Archiv - European Journal of Physiology, (2016), 468(9): 1609-1619.
(6) Nin F, Yoshida T, Sawamura S, Ogata G, Ota T, Higuchi T, Murakami S, Doi
K, Kurachi Y, Hibino H. The unique electrical properties in an extracellular
fluid of the mammalian cochlea; their functional roles, homeostatic processes,
and pathological significance. Pflügers Archiv - European Journal of Physiology, (2016), 468(10): 1637-1649.
(7) Yoshida T, Nin F, Ogata G, Uetsuka S, Kitahara T, Inohara H, Akazawa K,
Komune S, Kurachi Y, Hibino H. NKCCs in the fibrocytes of the spiral ligament
are silent on the unidirectional K+-transport that controls the electrochemical
properties in the mammalian cochlea. Pflügers Archiv - European Journal of Physiology, (2015), 467(7): 1577-1589.
(8) Adachi N, Yoshida T, Nin F, Ogata G, Yamaguchi S, Suzuki T, Komune S, Hisa
Y, Hibino H#, Kurachi Y#. The mechanism underlying maintenance of the endocochlear
potential by the K+ -transport system in the fibrocytes of the inner ear.
Journal of Physiology (London), (2013), 591(18): 4459-4472. [#: equal corresponding authors]
(9) Nin F, Hibino H#, Murakami S, Suzuki T, Hisa Y, Kurachi Y#. A computational
model of a circulation current that controls electrochemical properties
in the mammalian cochlea. Proceedings of National Academy Sciences of the United States of America, (2012), 109(23): 9191-9196. [#: equal corresponding authors]
(10) Nin F*, Hibino H*, Doi K, Suzuki T, Hisa Y, Kurachi Y. The endocochlear
potential depends on two K+ diffusion potentials and an electrical barrier
in the stria vascularis of the inner ear. Proceedings of National Academy Sciences of the United States of America, (2008), 105(5):1751-1756. [*: equal contributors]
(11) Hibino H, Kurachi Y. Molecular and physiological bases of the K+ circulation
in the mammalian inner ear. Physiology (Bethesda), (2006), 21:336-345.
(12) Hibino H, Horio Y, Inanobe A, Doi K, Ito M, Yamada M, Gotow T, Uchiyama
Y, Kawamura M, Kubo T, Kurachi Y. An ATP-dependent inwardly rectifying
potassium channel, KAB-2 (Kir4.1), in cochlear stria vascularis of inner
ear: its specific subcellular localization and correlation with the formation
of endocochlear potential. Journal of Neuroscience, (1997), 17(12):4711-4721.
(13) Uetsuka S*, Ogata G*, Nagamori S*, Isozumi N, Nin F, Yoshida T, Komune S, Kitahara T, Kikkawa Y, Inohara H, Kanai Y, Hibino H. Molecular architecture of the stria vascularis membrane transport system, which is essential for physiological function of the mammalian cochlea. European Journal of Neuroscience, (2015), 42: 1984-2002. [*: equal contributors]
 もう一度、内耳が働く仕組みを簡単にご説明します。図1は、三つの管から成る蝸牛の断面図です。上下二つの管は、通常の細胞外液や血液と類似の「外リンパ液」を含んでいます。一方、中央の管には、「内リンパ液」と呼ばれる特殊な体液が満たされています。 これは、細胞外液であるにも関わらず、150 mMの高K+(カリウムイオン)と2 mMの低Na+(ナトリウムイオン)を含みます。まるで、細胞内の環境のようです。 しかも、内リンパ液は、外リンパ液を基準とすると、常に+80 ~ +100 mVの高電位を示します。このような特殊な電位・イオン環境は、有毛細胞の鋭敏な働きや聴覚の高い感受性に必須であり、破綻すると難聴が起こります。
もう一度、内耳が働く仕組みを簡単にご説明します。図1は、三つの管から成る蝸牛の断面図です。上下二つの管は、通常の細胞外液や血液と類似の「外リンパ液」を含んでいます。一方、中央の管には、「内リンパ液」と呼ばれる特殊な体液が満たされています。 これは、細胞外液であるにも関わらず、150 mMの高K+(カリウムイオン)と2 mMの低Na+(ナトリウムイオン)を含みます。まるで、細胞内の環境のようです。 しかも、内リンパ液は、外リンパ液を基準とすると、常に+80 ~ +100 mVの高電位を示します。このような特殊な電位・イオン環境は、有毛細胞の鋭敏な働きや聴覚の高い感受性に必須であり、破綻すると難聴が起こります。  現在、様々な周波数や大きさの音が入った時の反応の調査や様々な病的状態の時の解析に取り組み始めています。また、内リンパ液の物性にも興味を持ち、その精密測定を目的として理工系の研究者と協働し新たな方法論を取り入れようとしています。
現在、様々な周波数や大きさの音が入った時の反応の調査や様々な病的状態の時の解析に取り組み始めています。また、内リンパ液の物性にも興味を持ち、その精密測定を目的として理工系の研究者と協働し新たな方法論を取り入れようとしています。


