腫 瘍
骨、筋肉、関節、神経などの運動器に発生する骨・軟部悪性腫瘍は総じて「肉腫」と呼称します。内臓臓器などに発生する「癌腫」と同様に生命を脅かす「がん」でありますが、「肉腫」の発生頻度は低く、「がん」全体の1%未満にすぎません。つまり、患者数が少なく、その治療を担当する医師数も少なく、さらに治療法などを研究する研究者数も少ない疾患です。 本国における、骨・軟部腫瘍診療の発展は、第二次世界大戦後に新潟大学整形外科第4代教授の田島達也先生や小嶋伊三郎先生らがアメリカに留学し、骨・軟部腫瘍に関する最先端の知識を本国に持ち帰ったことに端を発します。以降、様々な研究が積み重ねられていき、1980年代にはそれまで不治の病とされた悪性骨・軟部腫瘍に治療成績の大きな改善がありました。それは、強力な抗がん剤治療が行われるようになり、さらにCTやMRIといった画像検査の開発、そして人工関節の開発やマイクロサージャリーなどの手術手技の発展がありました。現在の悪性骨・軟部腫瘍の5年相対生存率*は60~70%程度となっていますが、さらなる改善が切望されています。私たちは日々の一人一人の患者さんの診療を通して、新たな診断・治療法につながる研究を模索しています。 *5年相対生存率:がんと診断された人のうち5年後に生存している人の割合がどのくらいかという指標
1 臨床研究
骨軟部腫瘍は稀な疾患でありかつ多彩な組織像をしめすことから顕微鏡を使った組織診断のみでは十分客観的な診断ができない例もあります。このため腫瘍細胞の染色体分析、転座遺伝子の検出、腫瘍特異的遺伝子変異の解析などを行い、より客観性をもった診断技術の開発を目指しています。実際に組織学的に診断に迷う例がこれら手法をもちいて確定診断にいたることがしばしばあります。また、近年では治療を始める前に遺伝子などを検査して患者さんの体質や病気のタイプを調べ、効果がより高いと期待でき、副作用がより少ないと見込まれる治療法を選択する個別化医療(ゲノム医療)が進んでいます。新潟大学医歯学総合病院はゲノム医療拠点病院に指定されており、ゲノム医療部と連携し、最先端の遺伝子解析技術による新規薬物療法の開発にも努めています。
手術法に関しては、できる限り切断術を避けるべく、1990年代から放射線処理骨による患肢温存術を行ってきました。四肢(手足)に発生した悪性腫瘍に対しては、腫瘍を切除したあとの欠損部に対して、いかに再建を行うかがその後の四肢の機能を維持するためには最大の課題となります。当科では腫瘍に侵され切除した骨などを摘出した後に、手術中に大量の放射線で処理することにより悪性細胞を死滅させたのちに、その骨を再利用(リサイクル)して四肢を再建する方法を取り入れてきました。このような再生医療・移植医療は近年になり、とても注目を集めていますが、私たちもこれまでの治療法の更なる改良や新たな治療法開発に努めていきます。
2 腫瘍と免疫に関する基礎研究
人体にはリンパ球やマクロファージなどの免疫細胞が備わっており、外敵から身を守ってくれています。しかし悪性腫瘍は自己の免疫細胞を巧妙に欺き、攻撃を回避しながら身体をむしばんでいきます。私たちのグループでは、骨軟部悪性腫瘍の微小免疫環境の解析や、自己血から分離・培養した免疫細胞を利用した治療に関する基礎研究を行なっています。近年では、T細胞に人工遺伝子を導入して腫瘍攻撃能力を強化した「CAR-T細胞療法(CAR:キメラ抗原受容体)」を骨軟部悪性腫瘍に応用する研究、これまで単独での培養・増殖が困難とされていた「NK細胞」を効率よく増殖させて治療に用いる研究に注力しています。本研究は新潟大学小児科教室と共同で推進しています。
脊椎・脊髄
脊柱後縦靭帯骨化症(OPLL)における3次元画像解析による骨化巣体積評価
OPLLの進展について、3DCTの3次元画像解析 (Mimics®, Materialise社)により、従来のX線の画像解析より詳細で定量評価が可能な、骨化巣の形態と体積評価法を初めて確立した (図1) (Izumi T, Watanabe K, et al. Eur Spine J, 2013)。年齢、頚椎可動域がOPLL増加の危険因子であることを明らかにした他、頚椎固定術の併用は、除圧術単独に比べ骨化巣の年毎増加率を有意に抑制し (固定群2.0%/年:除圧群7.5%/年)、OPLLへのメカニカルストレスの軽減がOPLLの成長を抑制する事を明らかにした (図2) (Katsumi K, Izumi T, Watanabe K, et al. Eur Spine J, 2016)。現在はより珍しい胸椎OPLLに着目し、症例によっては後方固定術後に骨化巣が縮小することもわかってきた (図3)。
また当科での研究以外でも、厚労省主導の難治性疾患政策研究事業のOPLLに関する調査研究にも参加し、「胸椎OPLLの原因遺伝子を調査する研究」「AIを用いた術前画像からOPLL術後の予後予測する前向き研究」など様々な研究を分担・協力して行っている。
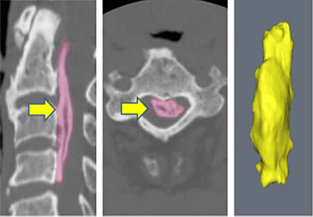
図1:頸椎OPLLの3次元画像解析 (CTより骨化巣を抽出し解析できる)
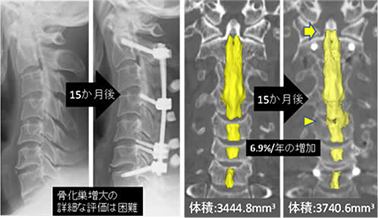
図2 :3次元画像解析による頚椎OPLL体積変化 (X線では骨化巣増大の詳細な評価は困難である)
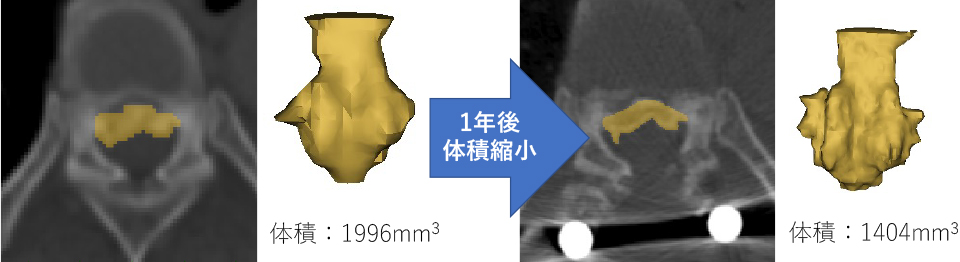
図3:胸椎OPLLの3次元画像解析
MRI拡散強調画像を用いた脊髄神経路における軸索変性、損傷の定量評価法
拡散強調画像から構成される三次元不等方性コントラスト(3DAC)画像を用いて、圧迫性頚髄症患者において、頚髄の中の微細構造である脊髄神経路変性の描出が可能であることを示した (Urakawa T, et al. Neurosurg Spine 2011) (図4:浦川貴朗ら、日整会誌2019より引用)。さらに、拡散テンソル解析のFA値を用いることで変性の程度が定量評価可能であることも明らかにした。
また近年拡散テンソルモデルに基づくFA値での定量解析を発展させ、より生体解析に則すとされる線形構造モデルを用いた定量評価法が行われるようになった (図5)。3DAC画像技術を応用し、神経路単位での脊髄微細構造の評価法を研究している。また、頚髄症患者を対象に、下肢加重計を用いた歩行機能解析、足底知覚検査、体性感覚誘発電位検査を行い、我々が確立してきた軸索変性、損傷の定量評価法との関連を解析している。
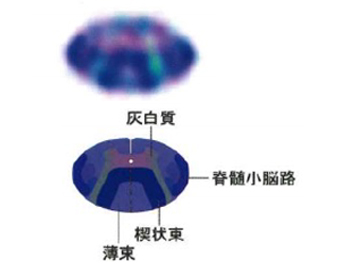
図4:三次元不等方性コントラスト(3DAC)画像

図5:線形構造モデル
脊髄損傷に対する脊髄保護療法の開発を目指した基礎研究 (図6)
脊髄損傷の二次損傷に深く関与している活性酸素の脊髄前角に対する作用機序を、電気生理学的実験 (パッチクランプ法)を用いて明らかにしてきた (Ohashi M, et al. J Physiolosy 2016; Ohashi M, et al. Neuroscience 2016)。さらに、脊髄損傷後の神経回路網の再生 (神経可塑性)促進を目指し、脊髄前角におけるモノアミンの作用機序も同様の手法で明らかにした (Shoji H, Ohashi M, et al. Neuroscience 2019)。これらの成果をもとに、脊髄損傷モデルラットを用いて、各種薬剤の脊髄保護効果に関する研究を行っている。さらに、脊髄損傷後疼痛の機序解明や新規薬物治療の確立を目指して、本学麻酔科学教室と共同で、電気生理学的実験、カルシウムイメージング、免疫組織化学的実験、行動学的実験などを駆使した基礎研究を行っている。
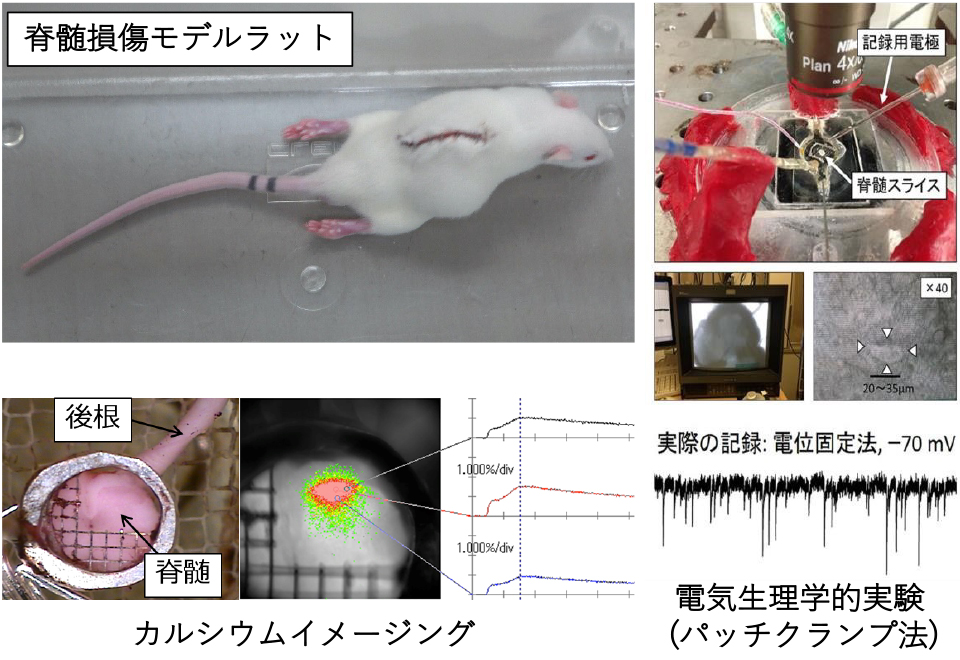
図6:脊髄損傷モデルラットを用いた基礎研究
ロコモ・サルコペニアに関するコホート研究:水中運動教室参加者の運動器検診
超高齢社会に直面して我が国の人口動態状況において、高齢者の運動器の健康を担保することは医療財政上の側面からみても喫緊の課題である。日本整形外科学会でも2007年に「ロコモティブ・シンドローム(ロコモ)」の概念を提唱し、全国民が運動器の健康維持への関心を高めるようプロモーションを行っている。
こうした背景の中、新潟県阿賀野市で市民の健康づくり対策の一環で2009年度からプールを利用した水中運動教室を開催しており、運動器を中心とした健康調査も施行してきた(図7)。我々は2019年度から運動器検診に参加し、腰痛関連QOLやロコモ・サルコペニアなどの関連を調査し、腰痛関連QOLとロコモについては強い関連性を認めることを報告した。現在も縦断的調査を継続しており、水中運動介入による体組成やQOL、運動機能の変化を解析中である。

図7:新潟県阿賀野市の水中運動教室
マイオカインに注目したサルコペニア治療の研究
運動が全身へ好影響を及ぼすことは広く知られており、身体不活動は死亡リスクとして日本で第3位と報告されている。そのため、運動困難な高齢者に対する「運動模倣薬」という概念が注目を浴びている。運動の全身への好影響を説明するものとして、骨格筋から分泌されるホルモンである「マイオカイン」が挙げられており、運動と同等の効果を発揮する薬物治療の開発を目指した基礎研究が活発に行われている。マイオカインは200種類以上の報告があるが、その相互作用も含めた詳細な作用機序は不明な点が多い。我々は、筋線維のリボソーム複合体を特異的に標識し精製できる遺伝子改変マウスを用いて、運動時に筋線維で翻訳されているRNAを網羅的に解析している。このシステムを利用し、運動の有益効果に関わるマイオカインの機能解明、及び、それに基づいた運動模倣薬開発を目指した基礎研究を行っている。
股関節
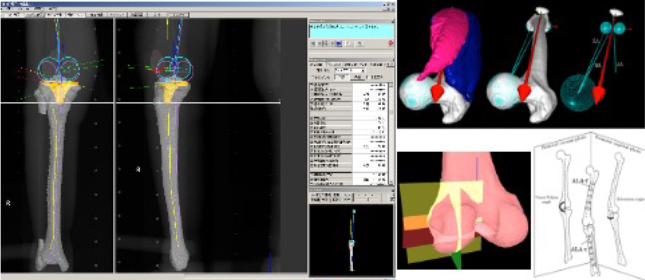
新潟大学股関節グループでは臨床で生じた疑問や問題点をひとつひとつ解決することを念頭に置き、臨床研究のテーマを考えております。人工股関節置換術後の合併症をゼロに近づけるため、日々手術を受けられる患者さん一人一人に対しての手術の適応・術前計画・手術操作の検討と術後管理を行い、そのデータを振り返ることを心がけております。そのためひと月に行える手術件数は限られます。新潟県内では新潟万代病院・新潟市民病院・済生会新潟病院・新潟臨港病院・県立新発田病院・立川総合病院・新潟労災病院,新潟大学魚沼基幹病院,県立燕労災病院などと協力して、臨床研究を通じて得られた結果を日常診療にフィードバックしております。特に人工股関節の設置位置・角度についての研究に力を入れております。人工股関節にも三次元的手法が普及されつつありますが、未だにその定義や理論などは未解明の部分が少なくありません。例えば、脱臼の原因としてインピンジメント(もの同士がぶつかるという意味)が脱臼の主要因とされ、特にインプラント同士がぶつかる『インプラントインピンジメント』が注目されるようになりました。
また、近年オフセット(特に股関節の場合は大腿骨が基準点からどれだけ外側に離れているか)の再現に力を入れており、至適なオフセット再現をできるように心がけております。最終的には人体における理想的設置位置を我々の症例から発見できるように研究に励んでおります。さらに、脊椎アライメントを考慮した至適設置角度の報告や寛骨臼回転骨切り術を行う際の股関節中心位置の変化に関する画像解析を当科で開発したソフト(ZedHip:レキシー社)を用いて解析しております。
ほかに人工股関節置換術周術期合併症のひとつである、静脈血栓塞栓症を減少させる方法や周術期の合併症の少ない疼痛管理など、日常診療に即した臨床研究も行っております。
膝・肩・スポーツ
新潟大学整形外科膝スポーツグループでは、バイオメカニクス研究、長期疫学研究、再生医療研究を3つの柱として行っています。具体的には1)三次元下肢アライメント解析・形態解析、2)三次元膝運動解析、3)人工膝関節置換術術中支援、4)松代膝検診の変形性膝関節症(以下、膝OA)コホート研究、5)膝OAの病因に関する研究、6)軟骨再生へ向けた基礎研究(脂肪幹細胞を用いた再生医療)、7)新たなPRP(多血小板血漿)治療の開発に向けた基礎研究などを施行しています。
整形外科医単独では限界のあるバイオメカニクス研究は、本学工学部、企業との医工連携を通し世界でも有数の研究体制を構築しています。立位荷重下での三次元下肢アライメントが評価できる当グループ独自の手法では、健常膝、変形性膝関節症をはじめとする各種病態膝、人工関節置換術後膝などのアライメント解析を施行しています。立位荷重下でのCT撮影が一般的ではない現状において、今後も同分野で新しい知見を提供できると考えており現在も研究を進めております。またCT画像とフラットパネルの動態画像をマッチングさせる2D-3Dイメージマッチング法や、モーションキャプチャシステム Viconと独自アライメント解析システムを組み合わせた運動解析は世界で当グループしかできない手法であり、新たな知見を求めてデータを収集し解析しています。
1979年以降、長年にわたり、新潟県十日町市松代地区にて行なっている疫学調査である松代膝検診は世界的な長期研究であり、これまで多くの貴重な結果が得られております。この検診から得られたデータをもとに現在も研究を続けており、現在ではバイオメカニクスの知識と技術も合わせて膝OAの病因に迫るべく研究を継続しております。
バイオロジーの分野では、軟骨再生へ向けた基礎研究として脂肪由来幹細胞移植による関節軟骨修復についての研究を施行しており臨床応用に向けて施行しております。またPRP治療に関する研究も歯学部、輸血部と共同研究体制を立ち上げ、将来の新たな治療確立に向け取り組んでいます。
三次元下肢アライメント解析、形態解析
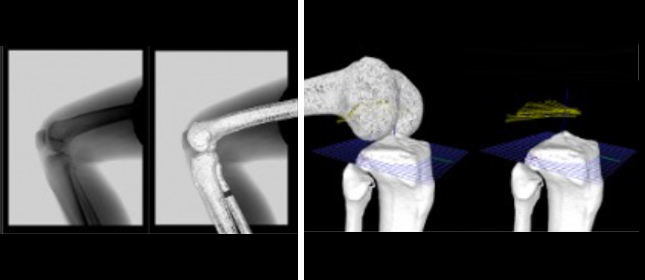
三次元膝運動解析
関節リウマチ
1 関節リウマチの骨と生体材料に関する研究
生体材料(β-リン酸三カルシウム;β-TCP)の組織内における細胞挙動について詳細に示しました[1,2]。 β-TCPはOSferionとして広く臨床で用いられている生体材料です。移植後早期に破骨細胞が出現しその後骨芽細胞が出現するというcoupling 現象が起きていることが明らかになりました。関節リウマチの実験モデルであるラットアジュバント関節炎の大腿骨顆部にβ-TCP移植後のビスホスホネートの作用を示しました[3]。ビスホスホネート投与によって、β-TCP周囲の破骨細胞の出現が高度に抑制されたことがわかりました。
またマウスに歯周病菌を投与し、そのごコラーゲン関節炎を引き起こした群に大腿骨皮質骨損傷モデルを作成したところ、骨損傷の再生過程が遅延することが明らかになりました[4]。
[1] Kondo N, Ogose A, Tokunaga K, et al. Biomaterials 2005.
[2] Kondo N, Ogose A, Tokunaga K, et al. Biomaterials 2006.
[3] Netsu T, Kondo N, Arai K, et al. J Bone Miner Metab 2012.
[4] Okumura G, Kondo N, Sato K, et al. Sci Rep 2019.
2 関節リウマチと酸化ストレスの病態に関する研究
関節リウマチの病態に酸化ストレスが関与することが知られていますが、生物学的製剤によってどのように影響を受けるかなどは不明でした。我々はRA患者の酸化ストレス値が恒常的に上昇していることに着目し、フリーラジカル分析装置(FREE)を用いて関節リウマチ患者血清の酸化ストレス値を計測しました。生物学的製剤とくにエタネルセプトあるいはトシリズマブによってRA疾患活動性の低下とともに酸化ストレス値は有意に低下しました[5]。分子生物学的に明らかにしようと数々の実験を行い、報告してきました。
関節リウマチ患者の滑膜組織において酸化ストレス応答系のNrf2の遺伝子およびたんぱく発現が上昇していることを示しました[6]。また、RA線維芽細胞株であるMH7A細胞において酸化ストレスによってnrf2が反応性に作用すること、JNK経路を介して酸化ストレス系を制御し、MMP-3の発現を抑えることから、JNK経路が重要な役割を果たしていることが明らかになりました[7]。
[5] Kondo N, Arai K, Netsu T, et al. Open J Rheumatol Autoimmune Dis 2017.
[6] Kondo N, Netsu T, Arai K, et al. Internet J Rheumatol Clin Immunol 2017.
[7] Kanai T, Kondo N, Okada M, et al. J Orthop Surg Res 2020.
3 非定型大腿骨骨折の疫学研究、病態に関する研究
2010年に非定型大腿骨骨折の症例を初めて経験し、2015年に報告いたしました[8]。
その後、治療に難渋する局面が続き、ビスホスホネート製剤の投与中止およびテリパラチドによって骨代謝動態が著しく改善し骨癒合に寄与したと思われる症例を報告しました[9]。
非定型大腿骨骨折の腸骨組織像を検討しましたがいわゆる過剰骨代謝回転抑制は30%程度であり、形態計測において骨形成パラメータが転子下骨折群で有意に低下していました[10]。骨折部局所の組織学的検討も行い、マイクロクラックが皮質内に認められる症例を報告しました[11]。現在は、骨折部の組織に着目し、新潟県関連施設の非定型大腿骨骨折症例を集積しデータを解析しております。また腎膠原病内科との共同研究、国立病院機構との共同研究(遺伝子研究)も並行しております。骨組織の解析については新潟骨の科学研究所と共同研究という形式で研究しております。
非定型大腿骨骨折の反対側の大腿骨における骨折リスクの研究を有限要素法を用いて行っておりますが、宮崎大学工学部 山子研究室との共同研究であります。
[9] Kondo N, Miyasaka D, Watanabe Y, et al. Mod Rheumatol Case Rep 2019.
[10] Kondo N, Fukuhara T, Watanabe Y, et al. Tohoku J Exp Med 2017.
[11] Watanabe Y, Kondo N, Fukuhara T, et al. Case Reports in Orthopedics 2021.
4 脊椎関節炎の研究
強直性脊椎炎の骨形態計測所見を示したほか[12,13]、強直性脊椎炎のTNF阻害薬IL17阻害薬の成績を解析しています。また関節炎発症ののち9.5年を経て乾癬を生じた乾癬性関節炎の症例を報告しました[14]。掌蹠膿疱症性骨関節炎にも着目し単一施設ではありますが臨床的特徴を51症例の検討で報告しています[15]。
[12] Kondo N, Yamamoto N, Watanabe K, et al. J Bone Biol Osteoporosis 2018.
[13] Kondo N, Mizouchi T, Kubota K, et al. Mod Rheumatol Case Rep 2020.
[14] Tsuchiya J, Kondo N, Fujimoto A, et al. Acta Medika Okayama 2020.
[15] Kondo N, Sakai Y, Kakutani R, et al. The J Dermatology 2021.
5 人工肘関節置換術の研究
新潟県立瀬波病院(現在の新潟県立リウマチセンターの前身)、京セラ、当科で開発した表面置換型の人工肘関節は1988年より高度肘関節破壊症例に用いられてきました。1999年に改良されNSKMと呼称が変更されました。この人工肘関節の中期成績を2020年に報告し、良好な成績であることを示しました[16]。この論文は、日本リウマチ学会診療ガイドライン2020にも取り上げられています。
[16] Kondo N, Arai K, Fujisawa J, et al. J Shoulder Elbow Surg 2019.
6 関節リウマチの実臨床患者における治療成績の研究(NOSRAD)
2019年より倫理委員会を通して新潟大学整形外科関節リウマチデータベースを立ち上げました。Niigata Orthopedic Surgery Rheumatoid Arthritis Database (NOSRAD;ノスラッド)と呼称しております。トシリズマブ皮下注射製剤は高齢発症関節リウマチで有効であるということを報告しました[17]。そのほか、セルトリズマブぺゴルの臨床成績を報告しました[18]。2021年10月現在、アバタセプト及びJAK阻害薬の臨床成績を解析しております。
臨床検体を用いた研究ではRA股関節病変の検討を行い、破壊した股関節病変の軟骨下骨組織では、骨形成も吸収パラメータも亢進していることが明らかになりました[19]。
最近ではRAに関するサイトカインネットワークの総説を発表しています[20]。
[17] Kondo N, Fujisawa J, Endo N. Tohoku J Exp Med 2020.
[18] Kondo N, Kudo N, Fujisawa J, et al. Clin Rheumatol Rel Res 2019.
[19] Kijima Y, Kondo N, Okumura G, et al. Acta Medica Okayama 2021.
[20] Kondo N, Kuroda T, Kobayashi D. Int J Mol Sci 2021.
2021年4月より、大学院生1名が所属し、基礎研究及び臨床研究を行っております。また、新潟県立リウマチセンター(https://www.ra-center.com)とも共同で研究に当たっています。
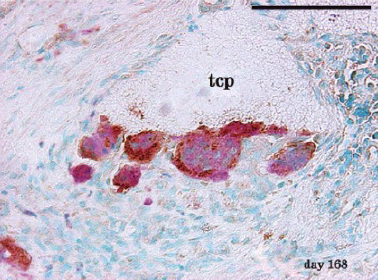
図1:骨組織 TCP Biomaterialsより。
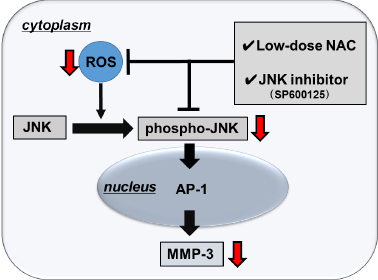
図2:酸化ストレスの研究の図
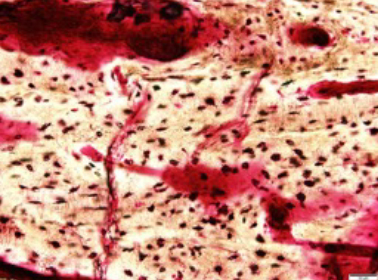
図3:非定型大腿骨骨折のマイクロクラック AFFより

図4:新潟京セラ瀬波モジュラー型(NSK-M)表面置換型人工肘関節
手外科
新潟大学手外科グループでは実臨床に基づいた臨床研究を中心に行っております。手外科の中で橈骨遠位端骨折という外傷がありますが、これは骨粗鬆症による骨脆弱性をもとに発症します。しかし骨粗鬆症の程度と橈骨遠位端骨折の重症度や合併損傷との関連はまだ十分明らかになっておらず、また骨粗鬆症治療と骨折の重症度軽減効果についても不明です。骨粗鬆症治療を行うことで橈骨遠位端骨折の重症度を軽減させたり、発症そのものを減少させることができるかについて研究しております。また近年注目されてきている、フレイル・サルコペニアといった心身の健康状態との関連についても研究を行っております。
また基礎研究に関しては有限要素法による解析を行い、骨折発症メカニズムの解明や骨切りによる応力変化について研究を開始しました。さらに今後は走査電子顕微鏡による末梢神経再生の研究を開始していく予定です。

