研究内容
はじめに(ミトコンドリアとオートファジーの紹介)
ミトコンドリアとオートファジー
ミトコンドリアは、細胞小器官という細胞を構成する構造体の一つで、摂取した栄養をATP(アデノシン三リン酸)という細胞が使いやすいエネルギーに変換する役割があります。発電所が、石油、石炭、ガス、原子力など取り扱いにくいエネルギーの塊から、電灯からパソコンまで何にでも使える「電気」という使いやすいエネルギーに変換し、各家庭に送り届けるように、ミトコンドリアは、食物から得た糖や脂肪などの栄養を単一のATPに変換し、細胞内に送り届けます。このミトコンドリアで産生されたATPを用いて、細胞は様々な活動が出来るようになります。例えば、筋肉を動かすのも、頭を使って考え事をするのもミトコンドリアが作ったATPを利用しています。
このように、ミトコンドリアは細胞が活動する上で必須の細胞小器官ですから、多くの研究者の興味を引きつけ、多くの研究が行われてきました。その中には、1978年ノーベル賞受賞者ピーター・ミッチェルによる化学浸透圧説や、1997年ノーベル賞受賞者ポール・ボイヤーとジョン・ウォーカーのATP合成酵素の研究など、多くの素晴らしい研究が含まれています。こうした研究の結果、現在では、食べた栄養がミトコンドリアの中でどのようにATPに変換されるのか、かなり詳しく解明されています。また、最近の分子生物学の発展により、ミトコンドリアがどうやって作られているのか、つまりミトコンドリアを構成する成分がどこで作られ、どのようにミトコンドリア内に運び込まれるのかも詳しく知られるようになりました。この様に、これまで多くの研究者を惹きつけ、現在はさらに盛んに研究されるようになっているミトコンドリアですが、未だにほとんど解明されていない事があります。それが、私たちの研究テーマである「ミトコンドリアの分解です」。
どのような物でも同じですが、例えば上記で例に用いた発電所の場合では、電力の需要に応じて発電所は新しく作られ、働き(発電すること)、古くなれば壊して新しいものに作り替えられます。電力の需要が減れば、壊すだけで新たに作らないということもあるでしょう。ミトコンドリアの場合も同じだと考えられます。私たちの体を構成している細胞の一部は、例えば神経細胞などは、100歳の方なら100年間も同じ細胞が使われています。この中にあるミトコンドリアも100年間、入れ替わりが起こっていないとはとても考えられません。必ず壊して、新しいものに作り替えられているはずです。しかしながら、これまでミトコンドリアを壊すことに関しては、ほとんど研究されていませんでした。少し前までは、ミトコンドリアのような大きな細胞小器官を分解する機構が存在するとは考えられなかったのだと思います。このミトコンドリアを分解する機構は、今ではミトコンドリアオートファジー(mitochondria autophagy又はmitophagy(マイトファジー))と呼ばれている、オートファジーによるミトコンドリア分解です。私たちは、様々な研究を通じてマイトファジーの存在を証明し、その分子機構の大部分を解明してきました(私たちの研究成果を参照)。マイトファジーのことは、後で詳しく説明するとして、まずはオートファジーについてです。
このように、ミトコンドリアは細胞が活動する上で必須の細胞小器官ですから、多くの研究者の興味を引きつけ、多くの研究が行われてきました。その中には、1978年ノーベル賞受賞者ピーター・ミッチェルによる化学浸透圧説や、1997年ノーベル賞受賞者ポール・ボイヤーとジョン・ウォーカーのATP合成酵素の研究など、多くの素晴らしい研究が含まれています。こうした研究の結果、現在では、食べた栄養がミトコンドリアの中でどのようにATPに変換されるのか、かなり詳しく解明されています。また、最近の分子生物学の発展により、ミトコンドリアがどうやって作られているのか、つまりミトコンドリアを構成する成分がどこで作られ、どのようにミトコンドリア内に運び込まれるのかも詳しく知られるようになりました。この様に、これまで多くの研究者を惹きつけ、現在はさらに盛んに研究されるようになっているミトコンドリアですが、未だにほとんど解明されていない事があります。それが、私たちの研究テーマである「ミトコンドリアの分解です」。
どのような物でも同じですが、例えば上記で例に用いた発電所の場合では、電力の需要に応じて発電所は新しく作られ、働き(発電すること)、古くなれば壊して新しいものに作り替えられます。電力の需要が減れば、壊すだけで新たに作らないということもあるでしょう。ミトコンドリアの場合も同じだと考えられます。私たちの体を構成している細胞の一部は、例えば神経細胞などは、100歳の方なら100年間も同じ細胞が使われています。この中にあるミトコンドリアも100年間、入れ替わりが起こっていないとはとても考えられません。必ず壊して、新しいものに作り替えられているはずです。しかしながら、これまでミトコンドリアを壊すことに関しては、ほとんど研究されていませんでした。少し前までは、ミトコンドリアのような大きな細胞小器官を分解する機構が存在するとは考えられなかったのだと思います。このミトコンドリアを分解する機構は、今ではミトコンドリアオートファジー(mitochondria autophagy又はmitophagy(マイトファジー))と呼ばれている、オートファジーによるミトコンドリア分解です。私たちは、様々な研究を通じてマイトファジーの存在を証明し、その分子機構の大部分を解明してきました(私たちの研究成果を参照)。マイトファジーのことは、後で詳しく説明するとして、まずはオートファジーについてです。
オートファジーとは
オートファジー(Autophagy)は、自食作用と訳されるように、細胞が細胞内のタンパク質さ細胞小器官を細胞内で消化・分解する現象です。このオートファジーは、ほとんどの真核生物に見られる現象で、細胞が生きていくために重要な役割を持っています。私たちヒトでも、パンを焼いたりワインを作ったりする時に使われる酵母と呼ばれる単細胞生物でも、栄養が摂取できなくなるとオートファジーが強く誘導されます。誘導されたオートファジーにより、細胞内のタンパク質やオルガネラが分解され、新しくアミノ酸や脂質などに変わります。この新しくできたアミノ酸などを使って、細胞は栄養が無い環境下で生き延びるのに必要なタンパク質を作り出し、危機を乗り越えようとします。
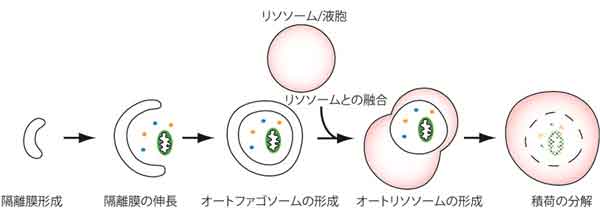
下図はオートファジーの模式図です。オートファジーが誘導されると隔離膜と呼ばれる脂質二重膜が細胞質内に現れ、伸長し細胞質にあるタンパク質やオルガネラなどの細胞質成分を包み込みます。完全に包み込んだ状態をオートファゴソームと呼びます。次に、このオートファゴソームがリソソーム(酵母の場合は液胞と呼ばれる)と融合します(正確にはオートファゴソームの外膜とリソソーム膜が融合します)。リソソーム内は酸性で、加水分解酵素で満たされており、これらの酵素により取り込まれた細胞質成分が分解されます。
この様な過程を経て、細胞質成分を分解するのがオートファジーです。オートファジーは、電子顕微鏡観察などにより1960年代からその存在は知られていましたが、1990年代に入るまでほとんど研究されることはありませんでした。1990年代になって、大隅良典先生(現東京工業大)らが出芽酵母を用いた実験により、オートファジーに必須な遺伝子群(ATG遺伝子)を同定したことを皮切りに研究が大きく前進し、現在ではオートファジーが分子機構レベルで解明されるに至っています。
下図はオートファジーの模式図です。オートファジーが誘導されると隔離膜と呼ばれる脂質二重膜が細胞質内に現れ、伸長し細胞質にあるタンパク質やオルガネラなどの細胞質成分を包み込みます。完全に包み込んだ状態をオートファゴソームと呼びます。次に、このオートファゴソームがリソソーム(酵母の場合は液胞と呼ばれる)と融合します(正確にはオートファゴソームの外膜とリソソーム膜が融合します)。リソソーム内は酸性で、加水分解酵素で満たされており、これらの酵素により取り込まれた細胞質成分が分解されます。
この様な過程を経て、細胞質成分を分解するのがオートファジーです。オートファジーは、電子顕微鏡観察などにより1960年代からその存在は知られていましたが、1990年代に入るまでほとんど研究されることはありませんでした。1990年代になって、大隅良典先生(現東京工業大)らが出芽酵母を用いた実験により、オートファジーに必須な遺伝子群(ATG遺伝子)を同定したことを皮切りに研究が大きく前進し、現在ではオートファジーが分子機構レベルで解明されるに至っています。
ミトコンドリアオートファジー(mitophagy/マイトファジー)と健康
ミトコンドリアオートファジー(mitophagy/マイトファジー)
一般的にオートファジーは、細胞質のタンパク質やオルガネラを非選択的に分解する現象です。しかしながら、研究が進むにつれて、オートファジーにはミトコンドリアやペルオキシソーム、小胞体などを他の細胞質成分から選択して分解する機能が備わっていることが明らかとなってきました。こうした分解対象を選択して分解するオートファジーは選択的オートファジーと呼ばれています。選択的オートファジーの中でも、私たちが研究対象としているのが、「オートファジーによる選択的ミトコンドリア分解」、即ちmitophagy(マイトファジー)です。
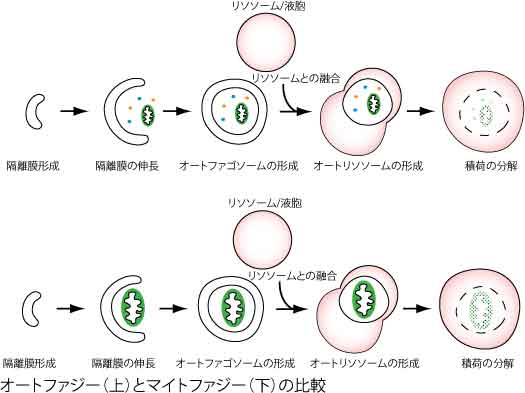
マイトファジーもオートファジーの一種ですから、ミトコンドリアを分解する過程の多くは、オートファジーと共通です。下図にオートファジーとマイトファジーの模式図を示しますが、オートファジーとの大きな違いは、「隔離膜が分解対象としてミトコンドリアを選択しているかどうか」ということです。それ以外は、ほとんど同じと言えるかもしれません。実際、私たちが出芽酵母で試したところ、オートファジーに必要な遺伝子(ATG遺伝子)の全てがマイトファジーにも必要であるが、ミトコンドリアの選択に関わる部分のみがマイトファジー特有の遺伝子であるという結果でした(Kanki & Klionsky, JBC 2008)。哺乳類の培養細胞でも、オートファジーに必要な遺伝子のほとんどはマイトファジーにも必要なようです。
マイトファジーもオートファジーの一種ですから、ミトコンドリアを分解する過程の多くは、オートファジーと共通です。下図にオートファジーとマイトファジーの模式図を示しますが、オートファジーとの大きな違いは、「隔離膜が分解対象としてミトコンドリアを選択しているかどうか」ということです。それ以外は、ほとんど同じと言えるかもしれません。実際、私たちが出芽酵母で試したところ、オートファジーに必要な遺伝子(ATG遺伝子)の全てがマイトファジーにも必要であるが、ミトコンドリアの選択に関わる部分のみがマイトファジー特有の遺伝子であるという結果でした(Kanki & Klionsky, JBC 2008)。哺乳類の培養細胞でも、オートファジーに必要な遺伝子のほとんどはマイトファジーにも必要なようです。
では、何故オートファジーはミトコンドリアを選択的に分解する必要があるのでしょうか?マイトファジーは、細胞にどんなメリットをもたらすのでしょうか?その正確な答えは未だに分かっていません。しかし、推測はできます。細胞中には、たくさんのミトコンドリアが存在します。これらのミトコンドリアの一部を分解するときに、わざわざ元気なミトコンドリアを分解する必然性は無いと思われます。逆に、異常なミトコンドリアや古くなったというミトコンドリアがあれば、それらが優先的に分解されることに合理性があります(古くなった表現が適当かどうか判りませんが)。即ち、マイトファジーは、細胞内の機能が低下してきたミトコンドリアを選択的に分解することにより、細胞内のミトコンドリア恒常性を維持しているだろうという考えです。この考えは、多くのマイトファジー研究者に支持されているようです。しかしながら、本当にマイトファジーが機能が低下したミトコンドリアだけを分解しているかどうか、実験的にはほとんど確かめられていません。このことを証明するのが、私たちの研究室の目的の一つです。
マイトファジーと健康
ミトコンドリアは、細胞が必要とするATPの大部分を作り出すオルガネラであるため、ミトコンドリアの異常は、様々な病気に結びつきます。上述のように、まだ完全に明らかになっているわけではありませんが、マイトファジーは、異常なミトコンドリアを分解することでミトコンドリア恒常性を維持していると考えられています。もしマイトファジーがうまく機能しなければ、細胞中に異常なミトコンドリアが蓄積し、様々な病気が発症するかもしれません。「老化」は病気ではありませんが、筋力が低下したり、動きが緩慢になったり、糖尿病や心血管疾患に罹りやすくなります。この原因の一部は、老化によるミトコンドリア機能低下です。マイトファジーは、老化によるこうした症状発症を抑制している可能性もあります。また、マイトファジーを誘導するような薬を見つけることができれば、老化に伴う症状やミトコンドリア関連疾患の治療・予防できるかもしれません。マイトファジーに関しては、未だに不明なことばかりで、これらはあくまで推測でしかありません。しかしながら、既に判っていることを組み合わせるだけでは、革新的な医療の進歩には結びつかないと思います。私たちの研究室では、マイトファジーを基礎から詳細に理解し、マイトファジーを利用した治療薬の開発にまで発展させようと、日々研究を進めています。
私たちの研究成果
選択的なミトコンドリア分解って本当に存在するのか?~その分子機構は?~
僅か7-8年前のことですが、マイトファジーの研究を開始した当時は、オートファジーがミトコンドリアを選択的に分解しているかどうかですら明らかではありませんでした。選択的にミトコンドリアを分解するためには、これがミトコンドリアだと識別するための「目印」がミトコンドリア上に必要ですし、細胞質には目印を識別し捕まえる為の因子も必要です。しかしながら、こうした因子は全く同定されていませんでした。私たちは、まず出芽酵母でマイトファジーを観察する方法を確立し、最初に目印を識別し捕まえる因子がAtg11であることを見いだしました(Kanki & Klionsky, JBC 2008)。次に、マイトファジー関連因子のスクリーニングを行い(Kanki et al. MBC 2009)、最終的にミトコンドリア上の目印に相当するAtg32を同定することに成功しました(Kanki et al. Dev. Cell 2009)。下図に示すように、ミトコンドリア上の目印であるAtg32が、細胞質のAtg11に識別され捕まえられる(結合する)ことによって、選択的なミトコンドリア分解が開始することが明らかとなったのです。
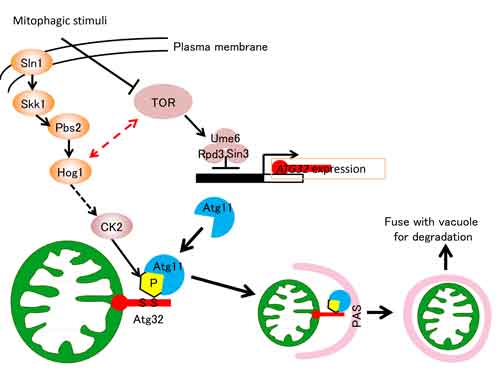
さらにその後もAtg32を中心に研究を続け、Atg32の114番目のセリン残基のリン酸化がAtg32とAtg11の結合に必須であること(Aoki et al. MBC 2011)、Atg32のリン酸化はKasein Kinase 2が行っていること(Kanki et al. EMBO Rep. 2013)や、マイトファジーの制御、即ちAtg32のリン酸化にはHog1 MAPキナーゼシグナル経路が重要であること(Aoki et al. MBC 2011)、TORの下流でUme6-Sin3-Rpd3複合体がAtg32遺伝子発現を抑制していること(Aihara et al. JCS 2014)など(全て上図参照)を出芽酵母におけるマイトファジーの分子機構の多くの解明に成功しています。
出芽酵母におけるマイトファジーの意義
「ミトコンドリアオートファジーと健康」の項目でも触れましたが、哺乳類ではマイトファジーは選択的に異常なミトコンドリアを分解することでミトコンドリア恒常性維持に貢献していると考えられています。しかしながら、出芽酵母ではマイトファジー遺伝子であるATG32を破壊することでマイトファジーを不能にした株でも、ほとんどミトコンドリアに異常は認められませんでした。出芽酵母は、ワインなどアルコールを作るのに利用されている生物です。糖類が十分存在する環境では解糖系のみでATPを産生し、ピルビン酸はエタノールに変換されます。哺乳類ならピルビン酸はアセチルCoAに変換されミトコンドリアでエネルギー源として利用されるのですが、出芽酵母ではこの反応がほとんどおきていません。即ち、ミトコンドリアはほとんど使われず、細胞内のミトコンドリアの量も非常に少なくなります。逆に、糖類が枯渇してくると、エタノールはピルビン酸に変換され、ミトコンドリアを使ってATPを産生するようになります。この時は、ミトコンドリア量も増加します。この様に、出芽酵母では、環境の栄養状態(炭素源の状態)によってミトコンドリアの量を変化させているのですが、ミトコンドリア量を減らすときにマイトファジーが大きく貢献しているようです。実際、マイトファジー不能なatg32破壊株では、ミトコンドリア量が減らないために、ストレス環境下ではミトコンドリアから出る活性酸素をうまく処理できずに、ミトコンドリア自体が酸化傷害を受けることが判りました(Kurihara et al. JBC 2012)。この様に、出芽酵母では、マイトファジーはミトコンドリア量の調整に大きく貢献しているようです。
哺乳類におけるマイトファジー
出芽酵母では、Atg32を中心としたミトコンドリア選択的分解機構を明らかにしてきたのですが、哺乳類では、未だにどのようにしてオートファジーがミトコンドリアを分解しているのか明らかになっていません。残念なことに、Atg32のホモログは、哺乳類には存在しないようです。さらに、哺乳類ではマイトファジーを観察するのが困難なことが研究を更に難しくしています。
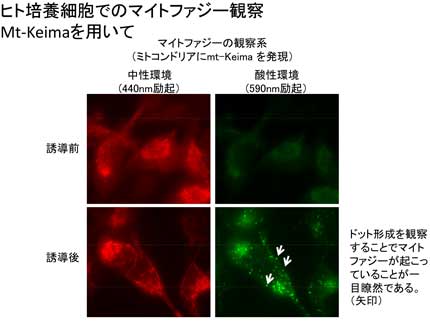
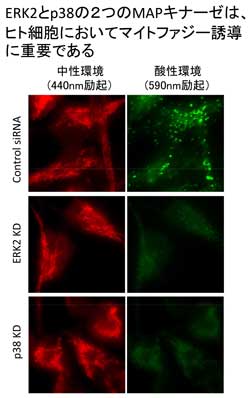
私たちは、哺乳類におけるマイトファジー研究を進めていくために、高感度なマイトファジー観察法を確立しました。これは蛍光タンパク質Keimaを用いる方法で、理化学研究所の片山先生・宮脇先生らが開発された方法です(Katayama et al. Chem Biol. 2011)。この方法を用いてマイトファジーを観察した所(下図左)、まずは、哺乳類細胞でも出芽酵母と同様にp38とErk2のMAPキナーゼシグナル経路が関わっていることが判明しました(下図右、Hirota et al. Autophagy 2015)。p38は、出芽酵母のHog1に相当するMAPキナーゼですから、哺乳類にはAtg32ホモログが存在しないとしても、哺乳類と出芽酵母の間でマイトファジーの誘導シグナルは共有されていそうです。
我々は、培養細胞系を用いてマイトファジーの研究を進めていますし、新たにマウスモデルも導入して、マイトファジーの生理的意義や疾患との関わりにまで踏み込んで研究を進めている所です。
私たちは、哺乳類におけるマイトファジー研究を進めていくために、高感度なマイトファジー観察法を確立しました。これは蛍光タンパク質Keimaを用いる方法で、理化学研究所の片山先生・宮脇先生らが開発された方法です(Katayama et al. Chem Biol. 2011)。この方法を用いてマイトファジーを観察した所(下図左)、まずは、哺乳類細胞でも出芽酵母と同様にp38とErk2のMAPキナーゼシグナル経路が関わっていることが判明しました(下図右、Hirota et al. Autophagy 2015)。p38は、出芽酵母のHog1に相当するMAPキナーゼですから、哺乳類にはAtg32ホモログが存在しないとしても、哺乳類と出芽酵母の間でマイトファジーの誘導シグナルは共有されていそうです。
我々は、培養細胞系を用いてマイトファジーの研究を進めていますし、新たにマウスモデルも導入して、マイトファジーの生理的意義や疾患との関わりにまで踏み込んで研究を進めている所です。