概要
哺乳類における脈管系は血管系とリンパ管系で構成されるからだのライフラインです。血管系は、動脈・静脈・毛細血管からなる秩序だった高次構造を形成して、全身に血液を輸送し末梢組織に酸素や栄養素などの物質を供給する上で重要な役割を果たしています。一方、リンパ管系は血管系と密接な位置に存在し、毛細血管領域から漏出したタンパクや組織間液を吸収して静脈角から血管系に戻す役割を果たしています。この二つの脈管系は発生学的に近縁関係にありますが、末梢ではお互いに吻合することなく、それぞれが独自の役割を果たしています。 私たちは、これまで血管・リンパ管発生の分子機構について研究する中で、胎生期に体液調節機構の軽微な変化があって浮腫(むくみ)を示しながら成体まで正常に発育する遺伝子変異マウスがいることを見出しました。このような研究の流れを背景に、血管・リンパ管の発生機構とその異常が引き起こす病態の研究から、将来のヒト周産期・小児医療への応用に資する基盤構築を目指しています。
胎児浮腫の病態と疾患発症リスク
近年、ヒト妊娠中に超音波検査が日常的に実施され、様々な子宮内症例が発見されるようになってきました。その内の一つである首の後ろにみられる胎児後頸部透亮像(項部浮腫,increased Nuchal Translucency)については、ダウン症(21トリソミー)などの染色体異常が原因として知られています。しかし、臨床的に羊水検査で染色体異常と確定診断されるのは10%程度で、大多数の症例で遺伝学的原因が不明です。この症例に関するさまざまな問題点が新聞等のメディアでも報じられています。
胎児の項部浮腫は、心脈管系の発生異常で細胞の生活環境である細胞間液の分布と循環が乱れて、組織が低栄養状態となることを示唆しています。近年提唱されている成人病胎児期起源説(Developmental Origin of Health and Disease, DOHaD)によると、胎児期あるいは出生直後の低栄養状態が生活習慣病の原因になるといいます。胎生期に浮腫をきたした個体が成体まで正常に発育しても、疾患リスクが潜んでいるかどうかを明らかにすることは極めて重要だと考えて研究を進めています。
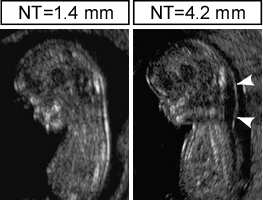
ヒト胎児の項部浮腫(矢頭)*1
<引用元>
*1. Haak MC and van Vugt JM. Hum Reprod Update. 2003 Mar-Apr;9(2):175-184より改変
リンパ管網形成の制御機構
胚性幹細胞(ES細胞)の分化培養系を用いて内皮細胞特異的に発現する分子の探索を行い、Aspp1を同定しました。Aspp1のノックアウト(Aspp1-/-)マウスを作製・解析したところ、 胎生期におけるリンパ管形成の遅延と浮腫を見出しました。著明な浮腫にもかかわらず、ほとんどのAspp1-/- マウスは出生し、乳児期に軽い成長障害が見られるものの成体まで正常に発育することが明らかになりました。成体Aspp1-/- マウスにおいては浮腫を認めないものの、本来は血管と伴走する集合リンパ管が蛇行や融合をするなどの特異なパターンとなることが分かりました。私たちは、Aspp1がどのようにリンパ管内皮細胞を制御しているのかについて研究することで、リンパ管疾患の原因解明や病態制御法の開発の基盤構築を目指しています。
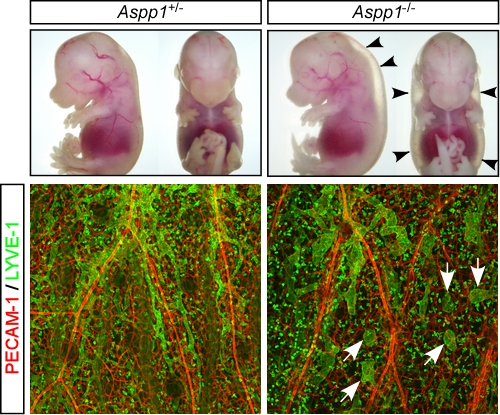
Aspp1-/-マウス胎児は項部浮腫(矢頭)を示し、皮膚にリンパ管の島様構造(矢印)がみられる
血管透過性の制御機構
脈管の解剖学的構造と微小形態はその機能と密接に関係しており、その発生・分化、そして維持機構に重要な因子として 血管内皮増殖因子(Vascular Endothelial Growth Factor; VEGF)ファミリーが同定されてきました。 近年、血管新生を伴う病気である緑内障、加齢黄斑変性症、進行性腫瘍や腫瘍転移などの治療標的として注目されており、抗VEGF-Aヒト抗体などの生物学的製剤による治療が行われています。VEGF-Aは受容体型チロシンキナーゼFlk1とFlt1を持ち、血管内皮細胞の増殖および血管透過性の亢進などを促します。 ノックアウトマウスの解析から、Flk1は血管内皮細胞の発生・分化に必須であり、Flt1はVEGF-Aの局所濃度を調節することが主な役割であると考えられています。
私たちは、Flt1のヘテロ欠損マウスが胎生期に一過性の項部浮腫をきたすことを見出しました。Flt1+/-マウスでは、もう一つの受容体であるFlk1シグナルが亢進して血管の透過性が亢進していることが分かりました。そこで、Flk1をヘテロ欠損させることでFlt1へテロ欠損による浮腫が抑制されるかどうか調べましたが、Flk1+/-; Flt1+/-マウスとFlt1+/-マウスでは同程度の浮腫を示しました。驚いたことに、Flk1+/-; Flt1+/-マウスの一部では、出生後に眼房水の調節異常で生じる牛眼が発症することが分かりました。牛眼発症の病態と分子機構を明らかにすることで、2つのVEGF-A受容体の未知の機能を明らかにできる可能性があると考えています。
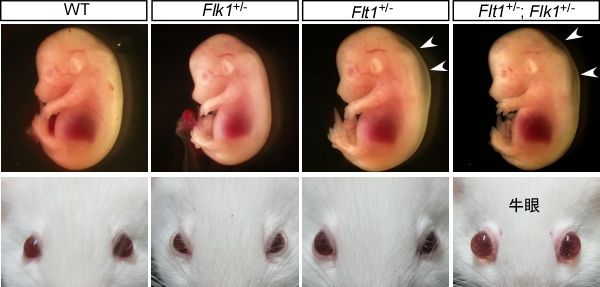
新しい胎児疾患モデルマウスの確立と病態制御法の開発
リンパ管形成遅延をきたすAspp1-/-マウスと血管透過性が亢進しているFlt1+/-マウスは、どちらも一過性の胎児浮腫を示すだけで成体まで顕著な異常を示さず発育します。胎生期における体液調節異常が胎児の生存に影響を与えるかどうか調べるために両方のマウスを交配すると、両方の遺伝子欠損をもつFlt1+/-; Aspp1-/-マウスでは、重度の浮腫を認め、その大部分が生まれてこないことが分かりました。これらのことから、非致死性の変化であっても複数のリスクが重なると、胎児に重篤な異常をきたすことが分かりました。
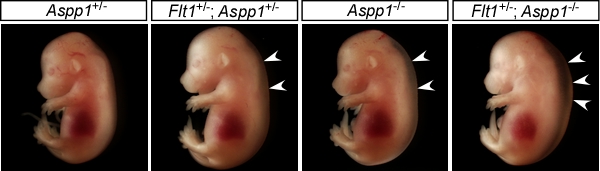
私たちは、ヒトの臨床的課題に応じた胎児疾患モデルマウスを効率的に作製する方法を立ち上げています。マウスの発生遺伝薬理学研究で遺伝学的原因を同定して、病態と成体における疾患発症リスクを解明し、疾患の予防・診断・治療技術シーズの開発に繋げることを目指しています。
リンパ管形成を制御する血管由来因子
マウスにおいて頸部静脈から分化したリンパ管内皮細胞は、二つの経路に分かれてリンパ管形成に関わると考えられています。1)頸部静脈の近傍で互いに接着して初期リンパ嚢を形成し、それらがお互いに融合して管腔形成しながら伸長します。2)頸部静脈に由来するリンパ管内皮細胞の一部は体表まで遊走して皮膚のリンパ管形成に貢献します。この遊走の際には先に形成されている血管とりわけ動脈の上を移動することが知られています。このように、リンパ管内皮細胞の分化とその後の形態形成は血管と密接な関連があります。私たちは、血管内皮細胞から産生・分泌されるセマフォリンや血管内を循環する血小板がリンパ管形成に果たす役割について研究してきました。
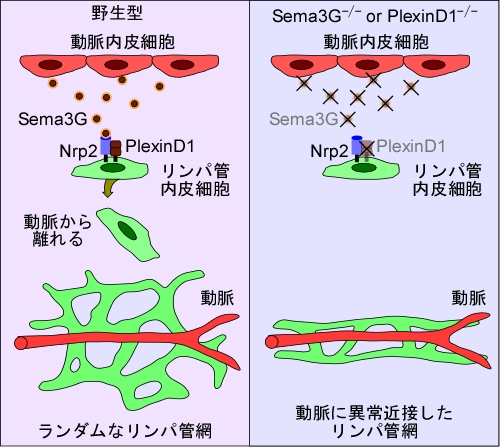
セマフォリン3G
セマフォリン3G(Sema3G)はガイダンス因子セマフォリンファミリーの一つで、クラス3に属する分泌型タンパクです。その発現様式は特徴的で、皮膚においては動脈の内皮細胞が特異的に発現しています。実は、頸部静脈の内皮細胞から分化・発生したリンパ管内皮細胞は動脈の上を遊走して皮膚まで到達します。私たちは、Sema3G-/-マウスにおいて、皮膚のリンパ管網が動脈に異常に近接していることを見出しました。同様の異常はセマフォリン受容体であるPlexin D1を欠損するマウスでも見られました。 Sema3Gは共受容体Neuropilin-2との結合を介して、Plexin D1依存的にリンパ管の分布を制御していることを明らかにしました。リンパ管分布を制御する反発因子としては最初の報告例だと思います。これから病態との関連などを含めて、研究を深めていきたいと思っています。
血小板
血小板は血液に含まれる細胞成分の一種で、血管壁が損傷した時に凝集して傷口を塞ぐのに重要な役割を果たしています。近年の研究から、血小板の活性化がリンパ管と血管の分離に重要であることが示唆されています。私たちは、山梨大学の井上克枝先生らとの共同研究で、血小板機能異常に基づく血管・リンパ管分離不全マウスの解析を行ってきました。リンパ管の独自性を守る血小板の作用機構は大変興味深い研究課題です。
吉松グループのプロジェクト
内皮間葉移行(内皮細胞性の喪失および間葉系細胞性の獲得)とさまざまな関連疾患
血管の内腔側にある内皮細胞は細胞間接着により血液の漏出を防いでいますが、この接着が弱くなると、漏出が起きて血液は効率よく循環できなくなります。この結果、血液の滞留は酸素や栄養分の供給不足によるエネルギー産生力の低下のみならず、免疫細胞の循環不足による免疫機能の低下が引き起こされ、さまざまな病態が進行していきます。がんの進展過程では、がん細胞が上皮間葉移行(EMT)を経て遊走能を獲得するので、漏出性を示す内皮細胞間から血管内へと浸潤しやすくなると考えられています(がんの転移のメカニズム)。この細胞間接着の低下は内皮細胞としての性質を失い間葉系細胞の性質を獲得する過程として知られる内皮間葉転換(内皮間葉移行)の際にも引き起こされます。これの代表的な誘導因子として、がんや慢性炎症において豊富に存在するTGF-βが知られています。近年、内皮間葉移行は内皮細胞としての機能低下のみならず、この間葉系細胞に分化転換したものが線維芽細胞として機能することで、さまざまな臓器の線維化やがんの悪性化(この場合にはがん関連線維芽細胞と呼ばれる)を促進することが示されています。これらの病態に加え現在までに、動脈硬化、肺高血圧症、心弁膜症、弾性膠原線維増殖症、進行性骨化性線維異形成症(FOP)、糖尿病性腎症などの進展に関わっていることが報告されています。
私たちは、このような線維芽細胞(厳密には筋線維芽細胞)ががんの悪性化に寄与すること、線維芽細胞増殖因子(FGF)シグナルがこれを抑制していること、この制御因子として転写因子Elk-1の役割を解明しました(Mol Oncol 2019)。また、炎症性サイトカインであるTNF-αがTGF-βによる内皮間葉移行の促進因子となること、この分子メカニズムとして内因性のTGF-βシグナルの増強が誘導されることを明らかにしました。さらにこのTGF-βシグナルの増強ががんの悪性化(EMT)を誘導することを示しました(Cancer Sci 2020)。また、リンパ管内皮細胞でも類似の現象が観察され、皮膚組織の老化と相関していることを報告しました。リンパ管内皮細胞における内皮間葉移行の分子メカニズムとしては、血管の場合と類似しているが異なっておりActivinシグナル(同じTGF-βファミリーシグナルに属する)の増強が誘導されることを明らかにしました(PLOS One 2020)。現在は、これらTGF-βやActivinの発現がどのようなメカニズムで制御されているかについて研究を進めています。
Akatsu*, Takahashi*, Yoshimatsu* et al., 2019 Mol Oncol
(https://www.amed.go.jp/news/release_20190703-02.html)
Yoshimatsu*, Wakabayashi, Kimuro et al., 2020 Cancer Sci
(https://www.eurekalert.org/pub_releases/2020-10/tmad-tpd100120.php)
Yoshimatsu*, Kimuro*, Pauty et al., 2020 PLOS One
腫瘍における血管新生とリンパ管新生
腫瘍が増大するには栄養と酸素の供給が必要であり、新たに形成される血管がその役割を担っています。この新生血管は腫瘍が主に産生する血管内皮増殖因子VEGFによって血管内皮細胞が腫瘍内に引き込まれ、形成されます。このことからVEGFを標的とした抗血管新生療法が行われてきました(代表例:ベバシズマブ)。しかしながら、がんの中にはこの治療法が有効でないものや、治療を行っているうちに抵抗性を示すものがあることが明らかになりがん治療を困難なものにしています。そこで私たちは血管新生を制御する別のシグナル経路として骨形成因子BMP-9/ALK1シグナルに着目し、VEGFおよびBMP-9を同時に抑制するFcキメラ蛋白質を作製しました。ヒト膵臓がん細胞をマウスに移植して作らせた腫瘍ではVEGFやBMP-9を単独で腫瘍に投与すると血管新生は抑制しましたが、腫瘍そのものは縮小しませんでした。このような腫瘍に対して、さきほどのFcキメラ蛋白質を投与すると、腫瘍の抑制に成功しました。この結果は、一つのシグナルの抑制では抵抗性を示すがんでも2つのシグナルを同時に抑制することで、抵抗性を示すリスクを軽減できて有効な治療法になることを示唆しています。
Akatsu, Yoshimatsu et al., 2017 Cancer Sci
腫瘍におけるリンパ管新生の役割についてはまだわかっていないことが多いですが、一つの機能としては、がんはリンパ管を介してリンパ節へと転移するので新たに形成されたリンパ管はがん転移の主な経路であると考えられています。
私たちは腫瘍リンパ管形成を制御するシグナルとして、PDGFRβおよびBMP-9を発見しました。ヒト膵臓がん細胞をマウスに移植して作らせた腫瘍では、PDGFRβシグナルを抑制するFcキメラ蛋白質によりリンパ管新生が抑制されました。また、同様の腫瘍でBMP-9の投与によりリンパ管新生が抑制されました。以上から、PDGFRβはリンパ管新生に対して正に、BMP-9は負に働くということが明らかになりました。今後も引き続き腫瘍血管・リンパ管新生に関与するシグナルについて研究を進める予定です。
Miyazaki*, Yoshimatsu* et al., 2014 Cancer Sci
(Selected for Issue Highlights: https://onlinelibrary.wiley.com/doi/epdf/10.1111/cas.12508)
Yoshimatsu et al., 2013 Proc Natl Acad Sci U S A
(http://www.m.u-tokyo.ac.jp/news/admin/release_20131016.pdf)






