2025年7月23日 抗インフルエンザ剤感受性低下株調査の結果
2024-2025年シーズンの日本におけるインフルエンザ流行株と抗インフルエンザ薬感受性低下株調査の概要(2025年7月23日時点)
2024年10月から2025年7月23日までの期間にわたり、日本各地でのインフルエンザ流行状況および薬剤耐性変異を持つインフルエンザウイルスの発生状況を調査しました。本調査では、バロキサビルに対する感受性が低下するPA遺伝子の変異、およびオセルタミビルを含むノイラミニダーゼ阻害剤に対する感受性が低下するNA遺伝子の変異を検出しました。
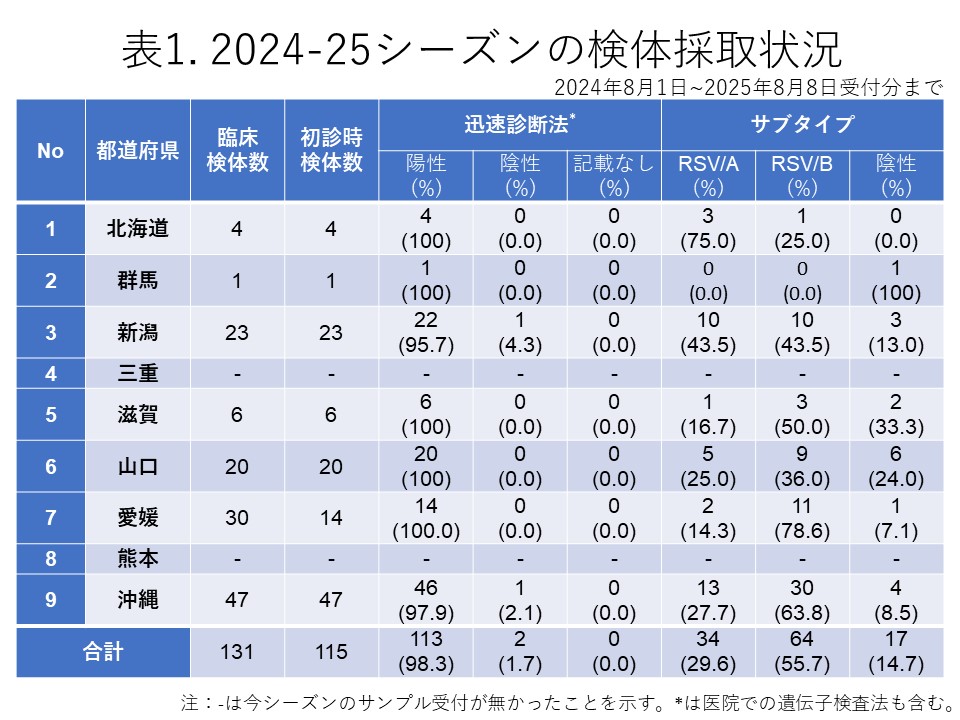
全国7道府県の外来医療機関が本研究に協力しました。発熱、咳、喉の痛み、だるさなど、インフルエンザが疑われる症状(インフルエンザ様疾患、ILI)がある患者のうち、迅速診断テスト(RDT)でインフルエンザA型またはB型陽性と判定された方から、上気道検体を採取し、これを初診時のサンプルとしました。また、バロキサビルを投与された患者には、3~7日後に再診をお願いし、その際に再診時の上気道検体を採取しました。これらの検体はすべて新潟大学に送付され、リアルタイムPCR(RT-PCR)法を用いてインフルエンザウイルスの検出、型/亜型の判定、PA変異およびNA変異の検出を、RT-PCR、サンガー法、次世代シーケンシング(NGS)を用いて行いました。
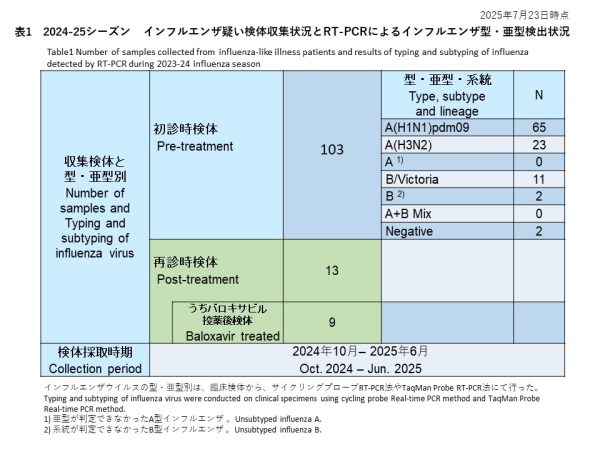
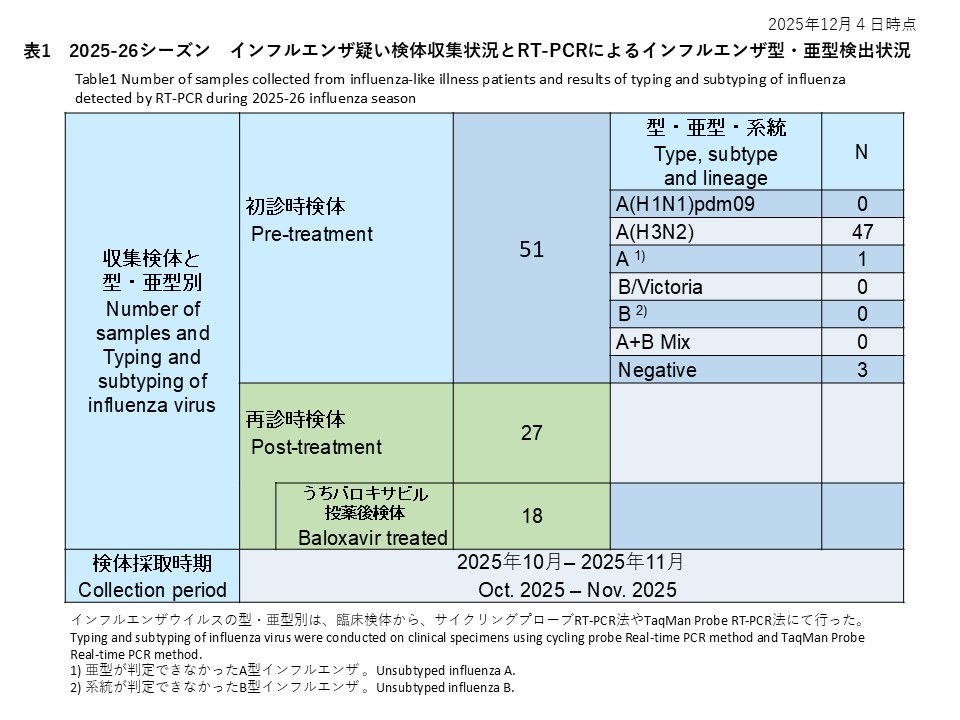
初診時に採取された103件の検体の内訳は、インフルエンザウイルスA(H1N1)pdm09が65件(63.1%)、インフルエンザウイルスA(H3N2)が23件(22.3%)、亜型判定不能のA型インフルエンザウイルスは0件(0.0%)、インフルエンザウイルスB/Victoriaが11件(10.7%)、系統が判定できなかったB型インフルエンザが2件(1.9%)でした。また、A型およびB型の混合感染は0件(0.0%)、RT-PCR陰性の検体は2件(1.9%)でした(表1)。
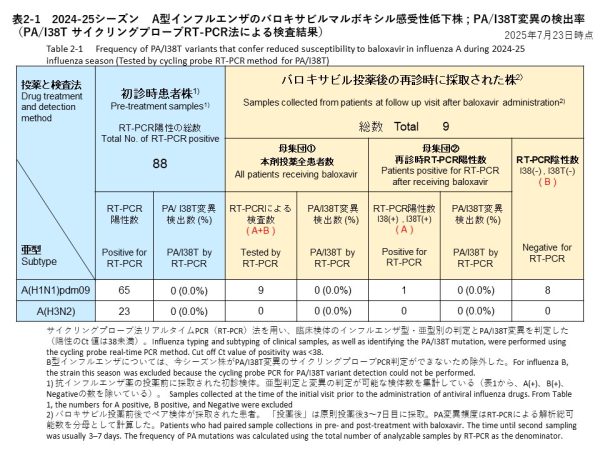
サイクリングプローブRT-PCR法を用いて、治療前に採取されたインフルエンザA型の検体から、PA/I38T変異の検出を試みた結果、65件のA(H1N1)pdm09と23件のA(H3N2)のいずれからもPA/I38T変異は確認されませんでした(検出率:0%)(表2-1)。
バロキサビル治療を受けた患者のうち9名(A(H1N1)pdm09が9名、A(H3N2)は0名)について、治療後3~7日目に再診時の上気道検体を提供いただきました。これらの検体に対して、サイクリングプローブRT-PCR法を用いてPA/I38T変異の有無を調べた結果、全ての検体から変異は検出されませんでした(検出率:0%)。RT-PCR検査結果の内訳は、PA/I38T変異無し(感受性株)が1件、PCR陰性が8件でした(表2-1)。
次世代シーケンサー(NGS)を用いて、PAおよびNA遺伝子における抗インフルエンザ薬耐性関連変異を検出しました。
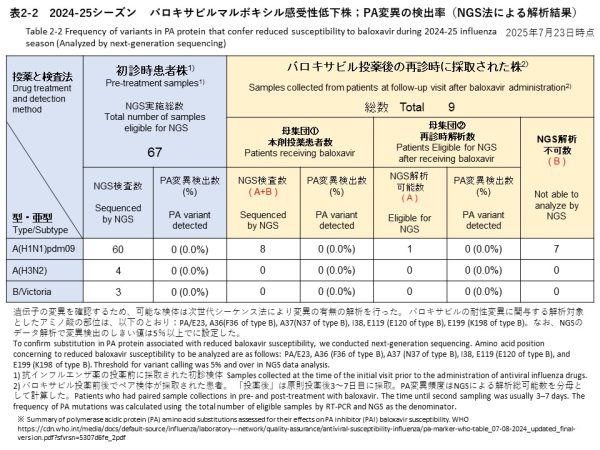
初診時に採取された検体のうち、NGS解析が可能であったのは67件で、内訳はA(H1N1)pdm09が60件、A(H3N2)が4件、B/Victoriaが3件でした(表2-2、表4)。
再診時検体では、NGS検査を実施できたのは12件で、そのうち8件がバロキサビル投与後、4件がオセルタミビル投与後の検体でした(表2-2、表4)。
【PA遺伝子解析】
[初診時検体] 全67件(A(H1N1)pdm09: 60件、A(H3N2): 4件、B/Victoria: 3件)を対象に解析を行った結果、バロキサビルに対する感受性低下に関連するPA遺伝子変異は確認されませんでした(表2-2)。
[再診時検体] バロキサビル投与後の再診時に採取された検体8件(すべてA(H1N1)pdm09)についてNGS解析を実施しました。このうち、解析可能だったのは1件のみで、感受性低下に関連する変異は検出されませんでした(検出率:0%)。
なお、サンガー法を用いたPA遺伝子の変異検出は、現時点ではまだ実施されていません。
【NA遺伝子解析】
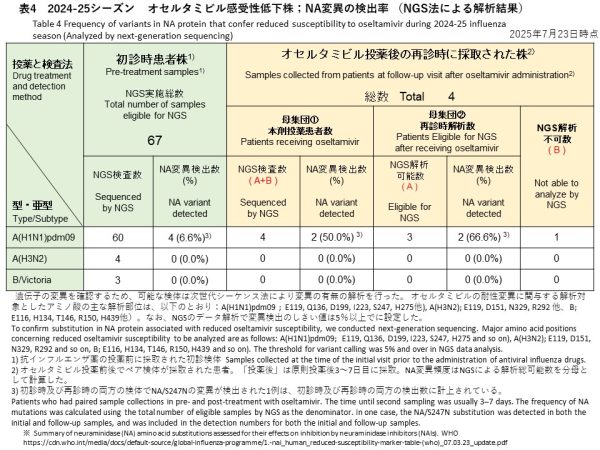
[初診時検体] 初診時に採取された検体67件(A(H1N1)pdm09: 60件、A(H3N2): 4件、B/Victoria: 3件)のうち、A(H1N1)pdm09検体からオセルタミビル耐性に関連するNA/S247N変異が1件、NA/H275Y変異が3件検出されました(検出率:6.6%)(表4)。バリアントコール解析では、これら変異の割合はいずれも99%以上であり、変異ウイルスが優勢であることが示されました。A(H3N2)およびB/Victoriaの検体では、耐性関連変異は検出されませんでした。
[再診時検体] オセルタミビル投与後の再診時に採取された4件(すべてA(H1N1)pdm09)に対しNGS解析を実施し、うち3件でデータ解析が可能でした。そのうち2件からNA遺伝子の変異が検出され、検出率は全体(4件)で50.0%、解析可能検体(3件)では66.6%でした。検出された変異は、初診時にNA/S247N変異が確認されていた患者の再診時検体で同変異が継続して検出されたもの(バリアントコール:99.6%)と、新たにNA/N295S変異が確認された1件(バリアントコール:18.7%)でした。
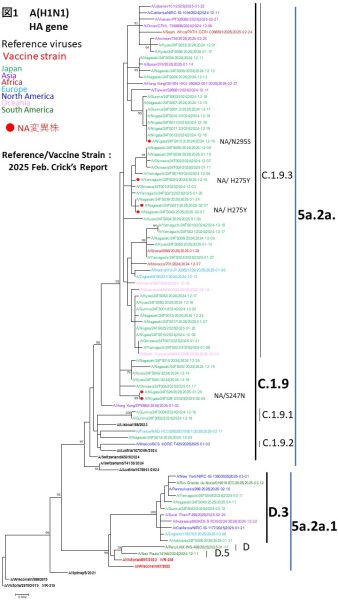
【HA遺伝子による系統樹解析】
2024年10月以降に日本で検出されたインフルエンザA(H1N1)pdm09のヘマグルチニン遺伝子(HA)の樹形図解析を実施いたしました(図1)。
解析対象の大半は、現在のワクチン株A/Victoria/4897/2022(IVR-238)が属する5a.2a.1(D)系統とは異なる、5a.2a(C.1.9)系統に分類されました。これらは、特にC.1.9.3サブクレードに属し、世界的に流行している株と一致していました。一方で、ワクチン株と同じ5a.2a.1(D)系統に分類される検体も、少数ながら検出されました。
また、ノイラミニダーゼ(NA)H275Y変異を有する3検体は、いずれもHA系統樹上で同一のクレードに集約する傾向をみせているため、今後、NA遺伝子の詳細な解析を実施する予定です。
Overview of Influenza Circulating Strains and Antiviral Drug-Resistant Strains in Japan During the 2024-2025 Season (As of July 23, 2025)
Between October 2024 and July 23, 2025, we conducted a study in Japan to monitor circulating influenza strains and the emergence of antiviral resistance. The study focused on detecting substitutions in the PA gene associated with reduced susceptibility to baloxavir and substitutions in the NA gene associated with reduced susceptibility to neuraminidase inhibitors, including oseltamivir.
Participating Medical Institutions and Sample Collection
Outpatient medical institutions in seven prefectures participated in this study. Upper respiratory tract samples were collected as initial samples from patients who visited these institutions with suspected influenza symptoms (influenza-like illness, ILI), such as fever, cough, sore throat, and fatigue. These patients were confirmed positive for influenza A or B using rapid diagnostic tests (RDTs). For patients treated with baloxavir, upper respiratory tract samples were also collected during follow-up visits 3–7 days after treatment. All clinical specimens were sent to Niigata University for influenza virus detection, subtype determination, and PA and NA substitution detection using real-time PCR(RT-PCR), Sanger sequencing, and next-generation sequencing (NGS).
Initial Sample Results
Of the 103 samples collected at the initial visit, 65 (63.1%) were identified as influenza A(H1N1)pdm09, 23 (22.3%) as A(H3N2), 11 (10.7%) as B/Victoria, and 2 (1.9%) as influenza B of undetermined lineage. No A/B co-infections were detected. Two samples (1.9%) were RT-PCR negative (Table 1).
Detection of PA/I38T Substitution in Pre-Treatment Samples
Cycling probe RT-PCR was performed to detect the PA/I38T substitution in influenza A samples collected prior to treatment. The PA/I38T substitution was not detected in any of the 65 A(H1N1)pdm09 or 23 A(H3N2) samples (detection rate: 0%) (Table 2-1).
Follow-Up Samples After Baloxavir Treatment
Among nine patients treated with baloxavir (all A(H1N1)pdm09), upper respiratory tract samples were collected 3–7 days post-treatment. PA/I38T substitutions were not detected in any of these samples by cycling probe RT-PCR (detection rate: 0%). Of these, one was classified as a susceptible strain without the PA/I38T substitution, and eight were PCR-negative (Table 2-1).
Whole-Genome Analysis Using Next-Generation Sequencing (NGS)
Whole-genome sequencing was conducted to investigate resistance-associated substitutions in the PA and NA genes.
-Initial samples: NGS analysis was successful in 67 samples, 60 A(H1N1)pdm09, 4 A(H3N2), and 3 B/Victoria (Tables 2-2 and 4).
-Follow-up samples: NGS analysis was successful in 12 follow-up samples, 8 following baloxavir treatment and 4 following oseltamivir treatment (Tables 2-2 and 4).
PA Gene Analysis
-Initial samples: No PA gene substitutions associated with reduced susceptibility to baloxavir were detected in any of the 67 samples (60 A(H1N1)pdm09, 4 A(H3N2), 3 B/Victoria) (Table 2-2).
-Follow-up samples: NGS analysis was performed on 8 follow-up samples after baloxavir treatment (all A(H1N1)pdm09). Of these, only 1 sample yielded analyzable sequence data, and no baloxavir resistance-associated PA substitutions were detected (detection rate: 0%).
Pending Analyses
As of now, substitution detection in the PA gene using Sanger sequencing has not yet been conducted.
NA Gene Analysis
-Initial samples: Among the 67 samples analyzed, oseltamivir resistance–associated substitutions were detected in 4 A(H1N1)pdm09 samples: one sample had the NA/S247N substitution, and three had the NA/H275Y substitution (detection rate: 6.6%) (Table 4). Variant calling showed that these substitutions were present at high proportions (>99%) in each sample. No such substitutions were detected in A(H3N2) or B/Victoria samples.
-Follow-up samples: Of the 4 follow-up samples after oseltamivir treatment (all A(H1N1)pdm09), NGS analysis yielded analyzable data for 3. Among these, resistance-associated NA substitutions were detected in 2 samples. The detection rate was 50.0% when calculated based on all 4 samples, and 66.6% when calculated based on the 3 analyzable samples. One sample carried the NA/N295S substitution, and another retained the NA/S247N substitution that had already been detected in the initial sample from the same patient. Variant calling revealed a substitution frequency of 18.7% for NA/N295S and 99.6% for NA/S247N.
Phylogenetic Tree Analysis of HA gene
A phylogenetic analysis of the HA gene of A(H1N1)pdm09 viruses detected in Japan since October 2024 was conducted (Figure 1).
Most of the sequenced viruses belonged to the 5a.2a (C.1.9) clade, which is distinct from the 2024–2025 vaccine strain A/Victoria/4897/2022 (IVR-238) that falls under clade 5a.2a.1 (D). The majority of strains were classified within the globally prevalent C.1.9.3 subclade. A small number of strains were also identified within the same 5a.2a.1 (D) clade as the vaccine strain.
Notably, the three samples with the NA/H275Y substitution are likely to cluster within the same HA clade, suggesting a possible genetic linkage. Further analysis of the corresponding NA genes is planned.