

腎分子病態学分野 教授
河内 裕
腎研究センター基礎部門の歴史は、1973年(昭和48年)に設立された腎研究施設にさかのぼります。木原達教授が主宰する病理形態学部門の一部門で発足し、昭和55年(1980年)に清水不二雄教授が主宰する免疫学部門が始動し、2部門体制になりました。平成8年(1996年)には新たに機能制御学分野が設置され追手巍教授が就任しました。平成11年(1999年)に山本格先生が木原達教授の後任として構造病理学分野(旧病理形態学部門)の教授に就任、平成20年(2008年)には清水不二雄教授の後任として河内が腎分子病態学分野(旧免疫学部門)の教授に就任しました。平成28年(2016年)の腎グループの再編成、腎研究センターの発足にともない腎研究施設は腎研究センター基礎部門として新たなスタートを切ることとなりました。
現在、腎研究センター基礎部門は、腎糸球体疾患の発症、進行機序の解明、腎不全へ腎研究施設、現在の腎研究センター基礎部門は、設立以来50年近く、全国で唯一の腎に関する特別研究施設、基礎研究部門として、研究、教育面での役割を果たしてまいりました。構造病理学分野は、病態形成機序の解明や薬剤開発に貢献してきた多くの病態モデルの開発、糸球体培養法の開発に多大な貢献をしてきました。山本教授は腎、糸球体の構成分子の網羅的解析を進め、腎のプロテオミクスデータベースを構築されるなど多大な功績を残しました。山本先生は退職後、寄付講座のトランスレーショナルリサーチ部門の生体液バイオマーカーセンターを立ち上げ、現在も活躍しています。現在、構造病理学分野の研究を牽引している矢尾板永信准教授は腎糸球体上皮細胞(ポドサイト)の画期的な培養法を開発し世界の腎臓研究者を驚かせました。矢尾板先生の開発した培養法はこの領域の研究に多大な貢献をしています。機能制御学分野は、追手教授、森岡哲夫准教授らが中心となり、糸球体の微小循環系の解析による硬化病変進行機序の解明に大きな成果を挙げました。またメサンギウム細胞-内皮細胞間相互作用についての研究でも多くの成果を挙げました。分子病態学分野は、1980年代から糸球体上皮細胞についての研究に取り組み、同細胞の細胞間接着装置であるスリット膜のバリア機能の破綻が蛋白尿の主因であることを世界に先駆けて発信し、スリット膜の分子構造の解明、ネフローゼ症候群の発症機序の解明に貢献してきました。
教育面では、国内はもとより中国、韓国をはじめとするアジア諸地域、欧州、米国などから数多くの大学院生、研究生を受け入れ、人材育成に努めてまいりました。若い日に新潟で学んだ人材が、現在の腎臓病学の中核を担うキーパーソン、国内外の腎関連施設の指導者として活躍されています。これまでに形成してきた世界に広がる人的ネットワークは、現在当部門の研究を進める上での貴重な財産となっています。
基礎部門の前身である腎研究施設の設立目的は、「腎に関する基礎的並びに臨床的諸問題の解明、腎疾患の予防及び薬物療法の研究」でした。腎臓病は今もなおアンメットメディカルニーズの高い領域で、より効果的な新薬の開発が待ち望まれています。現在、私たち基礎部門は、これまでの基礎研究での成果に立脚し、新規治療薬の開発に向けた研究に取り組んでいます。研究成果を一日も早く患者様のもとに届けることができるよう、スタッフ、構成員一丸となって努力してまいります。
| 河内 裕 教授 プロフィール | |
|---|---|
| 1987年 | 新潟大学医学部医学科 卒業 |
| 1991年 | 新潟大大学院医学研究科 修了(医学博士) |
| 1991年-92年 | 日本学術振興会特別研究員 |
| 1992年-95年 | 米国ボストン大学医療センター 研究員 |
| 1995年 | 新潟大学腎研究施設 助手 |
| 1997年 | 新潟大学腎研究施設 助教授 |
| 2008年 | 新潟大学腎研究施設 教授 |
| 2015年 | 新潟大学腎研究施設 施設長 |
| 2016年 | 新潟大学腎研究センター基礎部門 教授 |
| 主な学会活動 | |
| 日本腎臓学会(幹事)、日本病理学会(刊行委員) 国際腎臓学会、アメリカ腎臓学会 など |
|
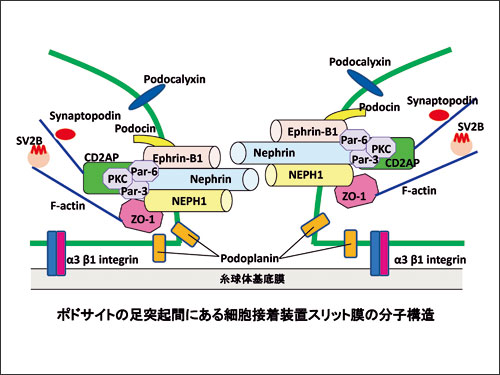
腎は、生体の水分、電解質を調節し、代謝でできた老廃物を尿として体外に排泄する役割を果たしています。腎の濾過装置である糸球体には、尿生成の過程で身体に必要な成分である血液中の蛋白質を尿として排泄しないようにするバリア装置がありますが、蛋白尿は、腎糸球体毛細血管壁のバリア機能の破綻によりもたられされます。糸球体毛細血管壁は内皮細胞、基底膜、糸球体足細胞(ポドサイト)の3層からなります。1990年代までは蛋白尿は基底膜のバリア機能の障害により発症すると考えられてきましたが、私たち腎分子病態学分野のグループは、ポドサイトのバリア機能の障害が蛋白尿の本体であるとする説を世界に先駆けて主張してまいりました。現在、この考え方が広く受け入れられています。スリット膜のバリア構造維持に最も重要な分子であるとされているのはNephrinと呼ばれる細胞膜1回貫通型の分子です。Nephrinは血清蛋白質の通過を防ぐ遮断機のような役割を果たしていると考えられています。私たちはNephrinの細胞外部の特定の部位を刺激することにより著明な蛋白尿が誘導されることを証明しました。しかし、スリット膜の分子構造、バリア障害の発症機序はまだ十分に解明されておりません。私たちは、正常糸球体とネフローゼ症候群モデルの糸球体の発現分子を詳細に比較することによりバリア機能維持に関わる分子群を同定してきました。(JASN17: 2748, 2006, Kidney Int 72: 954, 2007, Am J Physiol300: R340, 2011)(現在わかっているスリット膜の分子構造は次ページの図です。)この中で私たちが現在注目している分子はSV2B、Ephrin-B1、Par 6です。KOマウスなどを用いた解析を行い、これら分子の発現低下、機能低下によりスリット膜の分子構造が変化し、著明な蛋白尿がもたらされることを報告してきました(Lab Inv 95: 534, 2014, JASN 29: 1462, 2018,Am J Pathol 190: 333, 2020)。Ephrin-B1は、Nephrin同様、1回膜貫通型の分子で、細胞外部でNephrinと結合しています。Nephrinが刺激を受けるとEphrin-B1がリン酸化し、スリット膜を裏打ちする分子群の分子構造、結合様式を変化させスリット膜のバリア機能が低下し、蛋白尿が発症することを証明しました。現在、リン酸化Ephrin-B1によりもたらされるシグナル系の解析を進めています。
私たちが同定してきたスリット膜の機能分子群は、蛋白尿に対する新規治療法開発のための標的分子としても重要であると考えられます。これらの分子群の中で現在、治療標的として注目しているのはSV2B(Synaptic vesicle protein2B)とその関連分子群です。これまでの一連の研究でSV2Bがポドサイトのスリット膜の近傍に発現していること、蛋白尿発症時その発現が著明に低下すること、Nephrinなどのスリット膜機能分子群の細胞内輸送に関与していることを証明してきました。SV2Bとその関連分子が治療標的となることについては既に特許を取得しており(特許第6770741)、これらの分子を標的とした新規治療法の開発に向けた研究を進めています。現在、製薬関連企業から供与をうけた各種化合物を用いたスクリーニング試験を行っています。
SV2Bはシナプス小胞膜の表面に発現している分子として同定、報告された分子で、その関連分子もシナプスの機能維持に関わる分子群として同定された分子です。これらの分子の一部は、神経領域では病態との関係についての検討が進んでおり、その分子に対する保護作用を持つ薬剤、化合物がすでに開発されているものもあります。私たちはこれらの薬剤、化合物の腎における効果の検討も進めております。治療効果を確認することができれば、腎疾患へ適応拡大などにより、比較的早期に臨床で利用することが可能だと考えております。
SV2B関連分子の一部は高度蛋白尿を呈する検体の尿中で検出されること、予後の悪い疾患で早期から検出できることを確認しており、これらの分子は、ネフローゼ症候群の予後判定マーカーとしても有用であることを示してきました。一連の分子は診断マーカーとしての特許を取得しています。その他、私たちが同定したスリット膜機能分子の関連分子の一部は病態鑑別のための尿中マーカーとして有用であることを確認しており特許出願しております。現在、診断キットの作製に向けた研究を進めています。
蛋白尿陽性者は心、脳など他臓器の疾患、生体各所の多くの組織障害の発症率が高い(脳血管疾患の発症率は約3倍)という統計データが報告されています。蛋白尿は腎機能(GFR)の低下に独立した危険因子であることも示されています。しかしながら、蛋白尿とこれらの疾患との(因果)関係は解明されていません。私たちは、蛋白尿とこれら他臓器疾患とに共通する発症メカニズムが存在すると考え研究を進めています。糸球体は動脈と動脈の間に位置する特殊な毛細血管網です。糸球体毛細血管壁のバリア障害により発症する蛋白尿は、生体各所の動脈系の障害を感知するモニターとしての役割を果たしていると考えています。また、これまでの一連の研究で、スリット膜の機能分子として同定した分子には血液脳関門や、胎盤バリアに共通する機能分子も含まれており、蛋白尿は生体各所のバリア機能の障害を示す症候と捉えることができます。ポドサイトは特徴的な突起を持つ終末分化細胞で、神経細胞と多くの機能分子を共有しています。ポドサイトの細胞間接着装置であるスリット膜は、神経細胞間の接合装置であるシナプスと共通の分子機構があると想定されます。私たちは蛋白尿とてんかんなど神経内科領域の障害とに共通する分子機構があることも示してきました。ポドサイトは内耳の有毛細胞と共通する分子機構が存在し、難聴関連分子のポドサイトでの発現も証明しています。神経内科領域、循環器内科領域、耳鼻科学領域の研究者との共同研究も進めています。蛋白尿発症の分子メカニズムの研究を通じて、多くの他臓器疾患の病態解明に貢献したいと考えております。

| 福住 好恭 准教授 | |
|---|---|
| 2008年 | 金沢大学大学院博士課程 修了 |
| 2008年 | ドイツホルムヘルツ研究所 研究員 |
| 2011年 | 新潟大学腎研究施設 助教 |
| 2015年 | 新潟大学腎研究施設 准教授 |
| 内許 玉楓 助教 | |
| 2008年 | 新潟大学大学院博士課程 修了 |
| 2008年 | 新潟大学腎研究施設 研究員 |
| 2015年 | 新潟大学腎研究施設 助教 |
| 安田 英紀 助教 | |
| 2017年 | 日本獣医生命科学大学大学院博士課程 修了 |
| 2017年 | 新潟大学腎研究センター 助教 |
腎糸球体の構造維持には、糸球体上皮細胞(ポドサイト)が重要な役割を演じています。ポドサイトは糸球体の基本構築を作り、ポドサイト障害は不可逆的病変の原因になります。当研究室では、このポドサイトを中心に細胞生物学的な特性を明らかにし、糸球体疾患の原因進展機序を解明する糸口にしたいと考えています。
当初、ポドサイト障害の可視化、細胞骨格、細胞間接着分子に注目して研究を進めてきました。その結果、細胞骨格のデスミン(Am J Pathol, 1990)、細胞間コミュニケーションのコネキシン43(Am J Pathol, 2002)がポドサイト障害のマーカーとなること、巨大カドヘリン分子のFAT1 (Kidney Int, 2001, Kidney Int 2005)、タイト結合構成分子のCAR (Lab Invest, 2003, J Am Soc Nephrol. 2007), クローディン5 (Cell Tissue Res, 2011)がポドサイト間を結び付けていることを見出しました。これらの分子の機能はほとんど明らかにされていなかったため、機能解析を行えるような培養細胞のアッセイ系も並行して目指しました。従来ポドサイト由来と考えられている多角形細胞はポドサイトの分化形質に乏しいため(Eur J Cell Biol, 1991, Cell Tissue Res, 2020)、糸球体単離法から、検討しなおしました。これにより、多くの分化形質を示すポドサイトの初代培養に成功しました(Cell Tissue Res, 2001, Kidney Int, 2006)。それでも、分化形質は培養中に経時的に急速に失われてしまうため(Nephrology (Carlton), 2014)、さらに分化形質を再現保持する培養条件を目指す必要がありました。細胞外基質、細胞密度、血清の有無を検討した結果、細胞突起勘合を示すポドサイト培養を世界で初めて確立することができました(Kidney Int, 2018)。今後は、この培養系を中心に、ポドサイトの機能分子、障害分子のアッセイを行い、ポドサイトの特性を解明していきたいと考えています。

| 矢尾板 永信 准教授 プロフィール | |
|---|---|
| 1981年 | 新潟大学医学部医学科 卒業 |
| 1982年 | 新潟大学腎研究施設 助手 |
| 1991年 | ドイツ癌研究センター 研究員 |
| 1999年 | 新潟大学腎研究施設 助教授(2007年から「准教授」に改称) |
| 主な学会活動 | |
| 日本腎臓学会(評議員)、日本細胞生物学会、アメリカ腎臓学会 | |