循環器学分野 南野 徹特色ある活動一覧に戻る
糖尿病の発症に関わる新たな分子を発見
医歯学総合研究科循環器学分野の南野徹教授らは、セマフォリン3Eという分子が肥満において糖尿病の発症に重要な役割を果たしていることを発見しました。セマフォリン3Eは、肥満した内蔵脂肪組織において発現が高まっており、これが脂肪組織に免疫細胞を誘導することで内蔵脂肪組織に炎症が起こり、糖尿病を引き起こしていることが明らかになりました。この研究により、肥満患者における糖尿病に対する、より効果的な新しい治療方法が開発されることが期待されます。本研究に関する論文は、「Cell Metabolism」の第18巻(491-504頁、2013年)に掲載されました。
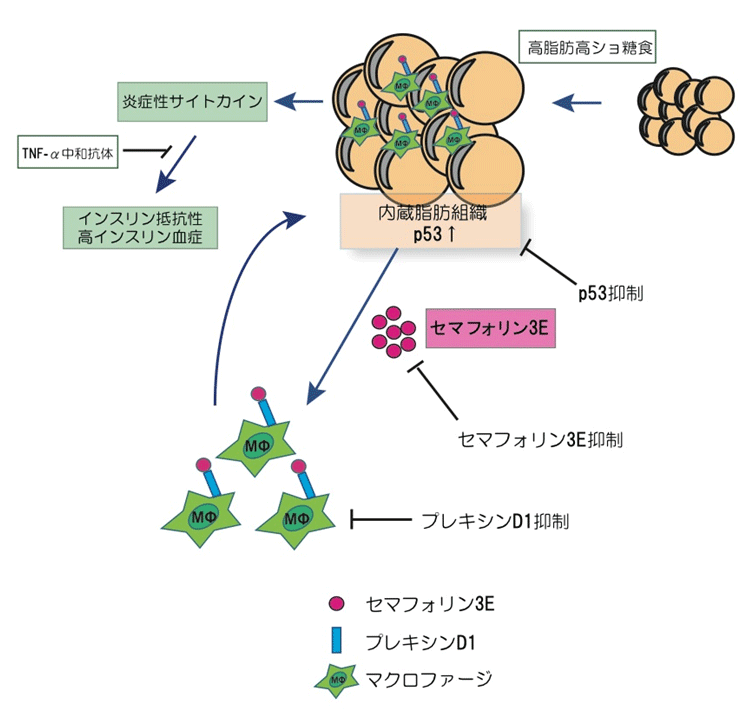
近年、肥満や糖尿病の患者は劇的に増加しており、現代社会の大きな問題となっています。全身のインスリン抵抗性や糖尿病の発症には、肥満に関連した脂肪組織の炎症が深く関与していることが知られており、炎症が生じた脂肪組織から産生された炎症性サイトカインが全身に循環することにより、骨格筋や肝臓といったインスリン標的臓器にも影響を及び、全身のインスリン抵抗性や糖尿病が引き起こされると考えられています。反発性の神経軸索ガイダンス分子であるセマフォリン3Eは、その特異的な受容体としてプレキシンD1が知られていますが、以前に南野教授らは、糖尿病ではセマフォリン3Eの発現が高まっており、これが虚血組織の血管新生を阻害することを報告しました。
今回、南野教授らは、肥満においてセマフォリン3Eが脂肪組織の炎症と全身のインスリン抵抗性を惹起することを明らかにしました。マウスに高脂肪高ショ糖食を与え、食餌誘導性の肥満モデルを作成すると、肥満マウスの内蔵脂肪組織では炎症が起こるとともに、インスリン抵抗性や耐糖能異常といった糖代謝異常を来していました。その際の脂肪組織を詳しく調べると、脂肪細胞でセマフォリン3Eの発現が、脂肪組織に浸潤する炎症細胞、特にマクロファージでプレキシンD1の発現が著明に亢進していました。セマフォリン3Eと結合しその作用を阻害する働きをもつ可溶性プレキシンD1を投与した肥満モデルマウスや、セマフォリン3Eホモノックアウトマウスの肥満モデルでは、脂肪組織の炎症は有意に改善し、糖代謝異常も著明に改善しました。反対に、脂肪組織においてセマフォリン3Eを過剰に発現したマウスでは、脂肪組織の炎症や著明な糖代謝の異常を来たしました。このことから、セマフォリン3E-プレキシンD1シグナルは肥満において脂肪炎症や糖代謝の異常を誘導する作用があることが示唆されました。
マクロファージなどの炎症細胞では、その細胞表面にCCL2受容体を発現しているため、炎症性サイトカインであるCCL2が分泌されるとそれに反応して炎症組織や感染組織に炎症細胞が誘導されることが知られています。そこで培養マクロファージ細胞を用いて細胞遊走アッセイを行いマクロファージの誘導性について検証したところ、セマフォリン3EはCCL2と同等にマクロファージを誘導する作用があり、マクロファージのプレキシンD1を抑制するとこの作用が抑制されることがわかりました。さらに、プレキシンD1の発現を抑制した骨髄を移植したマウスを作成したところ、これらのマウスでは肥満における脂肪炎症や糖代謝の異常が抑制されました。このことから、肥満においてマクロファージの脂肪組織への浸潤はプレキシンD1を介して誘導されると考えられました。
以前に南野教授らは、肥満においては酸化ストレスやDNA損傷が蓄積し脂肪組織でp53が活性化すること、活性化したp53は脂肪組織の炎症を惹起し、全身のインスリン抵抗性を引き起こすことを報告しました。そこで脂肪組織に特異的なp53ノックアウトマウスを作成したところ、このマウスでは肥満における脂肪炎症や糖代謝異常が抑制されましが、このマウスに可溶性プレキシンD1を投与しても相加的な改善効果はありませんでした。野生型マウスの脂肪組織にp53活性化剤であるキナクリンを投与したところ、セマフォリン3Eの発現が亢進するとともに、脂肪炎症や糖代謝の異常が惹起されましたが、これらの変化は脂肪組織に特異的なp53ノックアウトマウスでは起こらず、キナクリンにより誘導される脂肪炎症はp53依存的なものであると考えられました。さらに、クロマチン免疫沈降法を用いて検証したところ、p53はセマフォリン3Eの発現を制御している可能性が示唆されました。また、キナクリンで脂肪組織のp53を活性化させたマウスに対し、可溶性プレキシンD1や炎症性サイトカインであるTNF-αの中和抗体を投与すると、脂肪組織の炎症や糖代謝の異常が改善しました。これらの結果より、肥満において生じるp53依存性の脂肪組織の炎症において、セマフォリン3Eはp53の下流シグナルとして重要な役割を果たしていると考えられました。
今回、南野教授らは、肥満においてセマフォリン3Eが脂肪組織の炎症と全身のインスリン抵抗性を惹起することを明らかにしました。マウスに高脂肪高ショ糖食を与え、食餌誘導性の肥満モデルを作成すると、肥満マウスの内蔵脂肪組織では炎症が起こるとともに、インスリン抵抗性や耐糖能異常といった糖代謝異常を来していました。その際の脂肪組織を詳しく調べると、脂肪細胞でセマフォリン3Eの発現が、脂肪組織に浸潤する炎症細胞、特にマクロファージでプレキシンD1の発現が著明に亢進していました。セマフォリン3Eと結合しその作用を阻害する働きをもつ可溶性プレキシンD1を投与した肥満モデルマウスや、セマフォリン3Eホモノックアウトマウスの肥満モデルでは、脂肪組織の炎症は有意に改善し、糖代謝異常も著明に改善しました。反対に、脂肪組織においてセマフォリン3Eを過剰に発現したマウスでは、脂肪組織の炎症や著明な糖代謝の異常を来たしました。このことから、セマフォリン3E-プレキシンD1シグナルは肥満において脂肪炎症や糖代謝の異常を誘導する作用があることが示唆されました。
マクロファージなどの炎症細胞では、その細胞表面にCCL2受容体を発現しているため、炎症性サイトカインであるCCL2が分泌されるとそれに反応して炎症組織や感染組織に炎症細胞が誘導されることが知られています。そこで培養マクロファージ細胞を用いて細胞遊走アッセイを行いマクロファージの誘導性について検証したところ、セマフォリン3EはCCL2と同等にマクロファージを誘導する作用があり、マクロファージのプレキシンD1を抑制するとこの作用が抑制されることがわかりました。さらに、プレキシンD1の発現を抑制した骨髄を移植したマウスを作成したところ、これらのマウスでは肥満における脂肪炎症や糖代謝の異常が抑制されました。このことから、肥満においてマクロファージの脂肪組織への浸潤はプレキシンD1を介して誘導されると考えられました。
以前に南野教授らは、肥満においては酸化ストレスやDNA損傷が蓄積し脂肪組織でp53が活性化すること、活性化したp53は脂肪組織の炎症を惹起し、全身のインスリン抵抗性を引き起こすことを報告しました。そこで脂肪組織に特異的なp53ノックアウトマウスを作成したところ、このマウスでは肥満における脂肪炎症や糖代謝異常が抑制されましが、このマウスに可溶性プレキシンD1を投与しても相加的な改善効果はありませんでした。野生型マウスの脂肪組織にp53活性化剤であるキナクリンを投与したところ、セマフォリン3Eの発現が亢進するとともに、脂肪炎症や糖代謝の異常が惹起されましたが、これらの変化は脂肪組織に特異的なp53ノックアウトマウスでは起こらず、キナクリンにより誘導される脂肪炎症はp53依存的なものであると考えられました。さらに、クロマチン免疫沈降法を用いて検証したところ、p53はセマフォリン3Eの発現を制御している可能性が示唆されました。また、キナクリンで脂肪組織のp53を活性化させたマウスに対し、可溶性プレキシンD1や炎症性サイトカインであるTNF-αの中和抗体を投与すると、脂肪組織の炎症や糖代謝の異常が改善しました。これらの結果より、肥満において生じるp53依存性の脂肪組織の炎症において、セマフォリン3Eはp53の下流シグナルとして重要な役割を果たしていると考えられました。
本研究において南野教授らはセマフォリン3E-プレキシンD1シグナルが脂肪組織の炎症を惹起し、インスリン抵抗性や糖尿病の発症・進展に重要な役割を果たしていることを明らかにしました。セマフォリン3EがプレキシンD1陽性マクロファージを誘導し、脂肪組織でのp53活性化がセマフォリン3Eによるマクロファージ誘導を促進することで脂肪の炎症や糖代謝異常が惹起されることが明らかになりました。癌抑制遺伝子であるp53は、DNA修復やアポトーシス、老化などに関連し、ゲノムの安定性の維持や発癌の抑制に寄与しています。近年、p53は加齢関連疾患にも関与しているということが知られてきており、加齢に伴ってp53の発現が亢進することや、p53の持続的な活性化は早期老化を引き起こすこと、老化した心血管ではp53の発現が亢進していることなどが知られており、動脈硬化や心不全といった疾患においても重要な役割を果たしていると考えられます。また、最近では代謝異常や代謝制御との関連性を示唆する報告もされています。本研究ではセマフォリン3E-プレキシンD1シグナルが、p53依存性の脂肪炎症において重要な役割を果たし、このシグナルの抑制が肥満時の代謝異常を改善させることを示しました。p53それ自体の抑制は発癌を誘導する可能性も考えられることから、セマフォリン3E-プレキシンD1シグナルの抑制は、肥満患者の糖代謝異常に対する新規治療ターゲットとなる可能性が示唆されます。
セマフォリン3EはプレキシンD1を発現したマクロファージの脂肪組織への浸潤を誘導し、脂肪組織の炎症を惹起してインスリン抵抗性を引き起こす
筆頭著者:清水逸平(Ippei Shimizu)、吉田陽子(Yohko Yoshida)
責任著者:南野徹(Tohru Minamino)
“Semaphorin3E-induced inflammation contributes to insulin resistance in dietary obesity”
Cell Metabolism, 18, 1-14(2013)
責任著者:南野徹(Tohru Minamino)
“Semaphorin3E-induced inflammation contributes to insulin resistance in dietary obesity”
Cell Metabolism, 18, 1-14(2013)