腎臓病の重要なサイン、タンパク尿発症のメカニズムを解明 −新規タンパク尿治療法開発のための標的分子を新たに同定−
新潟大学大学院医歯学総合研究科腎研究センター腎分子病態学分野の河内裕教授、福住好恭准教授らの研究グループは、タンパク尿(血液中のタンパク質が尿に漏れ出てしまっている状態)発症の責任部位である腎糸球体上皮細胞(注1)スリット膜(注2)のバリア機能維持のための分子連結構造を解明し、その連結構造が崩壊しタンパク尿が発症するメカニズムを明らかにしました。タンパク尿発症メカニズムは未解明な部分が多く、有効な治療薬が開発されていません。本研究成果は新規タンパク尿治療法開発への貢献が期待されます。この研究成果は、2021年7月1日にAmerican Journal of Pathology誌(米国病理学会誌)に掲載されました。
【本研究成果のポイント】
・タンパク尿(血液中のタンパク質が尿に漏れ出てしまっている状態)の発症を防ぐ装置である腎糸球体上皮細胞スリット膜のバリア機能維持に細胞膜の裏打ち分子(注3)であるNHERF2(注4)が重要な役割を果たしていることを明らかにした。
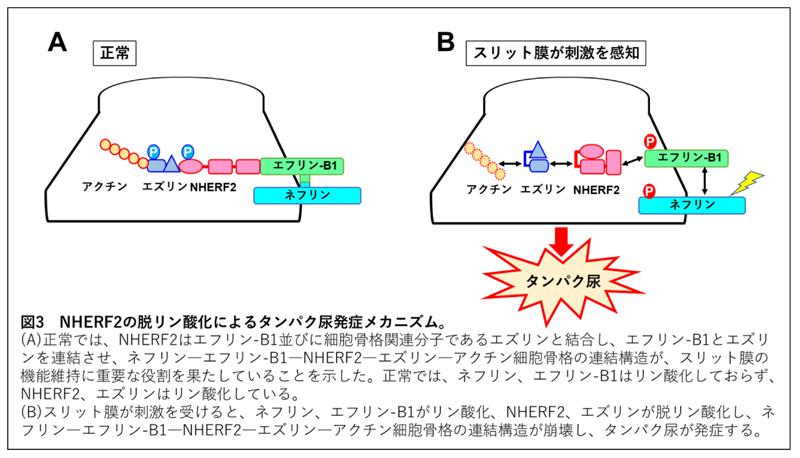
・NHERF2はスリット膜の細胞膜分子であるネフリン、エフリン-B1と細胞骨格関連分子であるエズリンとを連結させる分子で、スリット膜構造の安定化、機能維持に重要な役割を果たしていること、スリット膜が刺激を受けるとNHERF2が脱リン酸化(注5)しスリット膜と細胞骨格の連結構造が崩壊しタンパク尿が発症することを示した。
・NHERF2の脱リン酸化抑制による新規タンパク尿治療法開発が期待される。
Ⅰ.研究の背景
慢性腎臓病(注6)の総患者数は、約1,300万人と推定されており、新たな国民病と捉えられています。腎臓の主な役割は尿を作ることです。腎臓は、人が生きていくために行われる代謝で生じた老廃物を血液から濾過して尿として排泄する仕事をしています。その際、身体に必要な血液中のタンパク質を尿中に漏らさないように分別するための濾過装置が糸球体と呼ばれる構造物です。タンパク尿はこの濾過装置の分別機能が低下し血液中のタンパク質が尿中に漏れ出てしまっている状態です。タンパク尿は、腎臓病の濾過装置の傷害を示す最も重要な臨床所見であり、タンパク尿自体が腎臓病をさらに進行させる悪化因子であることが明らかになっています。また、タンパク尿を示す人は、脳卒中や心血管疾患の発症率が約3倍以上であると報告されています。タンパク尿は腎臓病のサインであるばかりでなく、生命予後に重大な影響を与える疾患の発症にも関連していることが明らかになっています。
本研究グループは、糸球体上皮細胞の細胞と細胞の間に存在するスリット膜という構造物が、タンパク質が尿中に漏れ出ないようにしている最終バリアで、踏切の遮断機に相当する役割を果たしていることを世界に先駆けて明らかにしました。この遮断機の構造が不安定になると、タンパク質が尿中に漏れ出てしまいます。この状態がタンパク尿です。これまでの研究で、この遮断機にはネフリン、エフリン-B1と呼ばれる分子が存在していることを明らかにしてきましたが、この遮断機を安定化させるための細胞の内側の分子構造は不明でした。
Ⅱ.研究の概要・成果
これまでの研究で、ネフリン、エフリン-B1がスリット膜のバリア構造を担う主要分子であることを明らかにしました。本研究では、エフリン-B1の関連分子を同定するため、次世代シーケンサ(注7)を用いて、エフリン-B1欠損マウス(エフリン-B1 KOマウス)で発現が変化している分子を網羅的に解析し、細胞膜の裏打ち分子であるNHERF2の発現が著明に低下していることを発見しました。この所見は、NHERF2がエフリン-B1の関連分子であることを示していると考え、NHERF2のスリット膜での発現、機能の検討を行い、NHERF2は、エフリン-B1並びに細胞骨格関連分子であるエズリンと結合しており、エフリン-B1とエズリンを連結させていることを明らかにしました。
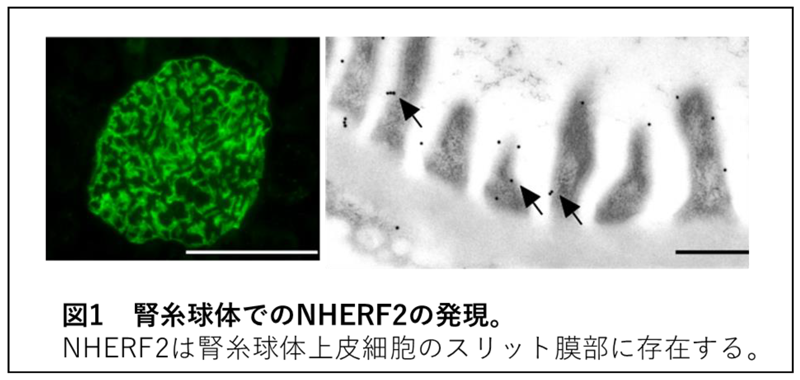
タンパク尿の発症時、糸球体上皮細胞の形態の変化、細胞骨格の異常も観察されるため、スリット膜の機能維持には細胞骨格との連結が重要であると考えられてきましたが、連結に関わる分子構造は解明されていませんでした。今回の研究で、NHERF2がスリット膜部に発現しており、スリット膜の細胞外部を構成する分子と細胞内の細胞骨格を連結させ、スリット膜を安定させるために重要な役割を果たしていることを明らかにしました。今回明らかにした<ネフリンーエフリン-B1―NHERF2―エズリンーアクチン細胞骨格>連結はスリット膜のバリア機能維持だけでなく、糸球体上皮細胞の形態維持に重要な役割を果たしていることを明らかにしました(図1参照)。
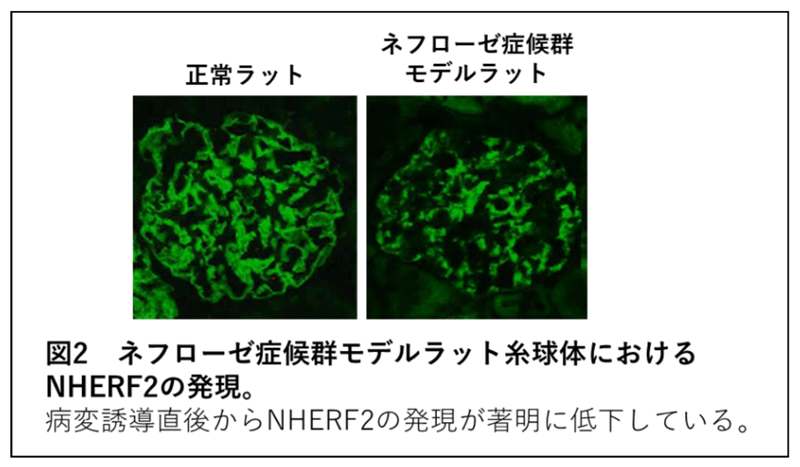
重篤なタンパク尿を示す病態であるネフローゼ症候群の実験モデルを用いた検討を行い、病変誘導直後からNHERF2の発現が著明に低下していることを観察しました(図2参照)。さらに培養細胞を用いた検討を行い、スリット膜が刺激を受けると、正常でリン酸化していないネフリン、エフリン-B1がリン酸化し、正常でリン酸化しているNHERF2、エズリンが脱リン酸化し、ネフリンーエフリン-B1−NHERF2−エズリンーアクチン細胞骨格の連結構造が崩壊することを示しました。この分子連結構造が崩壊することにより、スリット膜のバリア機能の障害が起こり、タンパク尿が発症すると考えられます。一連の変化においてNHERF2の脱リン酸化がこの分子連関を崩壊させるキーイベントであることを明らかにしました(図3参照)。
Ⅲ.今後の展開
NHERF2の脱リン酸化抑制は、タンパク尿、ネフローゼ症候群の新規治療法開発のための戦略として重要であると考えます。今後、各種薬剤、化合物を用いた検討を行い、タンパク尿の新規治療薬の開発を目指します。
Ⅳ.研究成果の公表
これらの研究成果は、2021年7月1日、American Journal of Pathology誌(インパクトファクター:4.037)に掲載されました。(本論文で発表した写真が掲載誌7月号の表紙に採用されました(図4参照)。)
論文タイトル:Nephrin-Ephrin-B1-Na+/H+ Exchanger Regulatory Factor 2-Ezrin-Actin Axis Is Critical in Podocyte Injury
著者:Yoshiyasu Fukusumi, Hidenori Yasuda, Ying Zhang, Hiroshi Kawachi
Department of Cell Biology, Kidney Research Center, Niigata University Graduate School of Medical and Dental Sciences, Niigata, Japan
doi: 10.1016/j.ajpath.2021.04.004
The American Journal of Pathology, Vol. 191, No. 7, July 2021
用語説明
(注1)腎糸球体上皮細胞:
糸球体を構成する3種の細胞の1つで、糸球体の最外層に位置し、糸球体の形態の維持、糸球体のバリア機能の維持において最も重要な役割を果たしている細胞。神経細胞や心筋細胞と同様、生体内で最も分化した細胞の1つで増殖能を持たない。
(注2)スリット膜:
糸球体上皮細胞間に存在する細胞間接着装置。血液中のタンパク質が尿中に漏れ出るのを防ぐ最終バリアとしての役割を果たしている。多くの腎疾患におけるタンパク尿は、スリット膜のバリア機能の障害により発症すると考えられている。
(注3)裏打ち分子:
細胞膜周辺の分子と相互作用し、細胞膜分子と細胞骨格を仲介する分子。
(注4)NHERF2(Na+/H+ exchanger regulatory factor 2):
細胞膜のタンパク質複合体を支える裏打ち分子の1つ。Na+とH+を交換する機能をもつ輸送体の関連分子として同定された。
(注5)リン酸化:
タンパク質の機能を変化させる化学反応(機能修飾)の1つ。タンパク質はリン酸化、もしくは脱リン酸化すると立体構造が変化し、機能、他の分子との結合性が変化する。タンパク質は、他のタンパク質をリン酸化、脱リン酸化させることによりシグナルを伝達させる。
(注6)慢性腎臓病:
腎の濾過機能を示す数値が60%未満になった状態、もしくは持続性のタンパク尿が確認されると慢性腎臓病と診断される。国内の総患者数は1,300万人と推定されている。慢性腎不全(腎機能が低下し、血液透析療法、腎移植が必要となる状態)の予備軍と考えられている。
(注7)次世代シーケンサ:
核酸(DNAとRNA)の塩基配列情報を読み取る装置(シーケンサ)の次世代型。塩基配列を大量に読み取ることができる。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科
腎研究センター 腎分子病態学
教授 河内 裕(かわち ひろし)
E-mail:kawachi@med.niigata-u.ac.jp