オートファジーによる脂肪酸代謝制御の仕組みを解明 〜新たな細胞生理機能の発見による生活習慣病の予防・治療へ〜
概要
順天堂大学大学院医学研究科器官・細胞生理学の小松雅明 教授(新潟大学大学院医歯学総合研究科 客員教授)、生化学・細胞機能制御学の横溝岳彦 教授らの研究グループは、オートファジー*¹により脂肪酸酸化(β酸化)*²が誘導される仕組みの解明に成功しました。研究グループは今回、栄養飢餓に応じて脂肪酸酸化を抑制する核内受容体コリプレッサー1(NCoR1)*³がオートファジー依存的に分解されること、オートファジーを肝臓で抑制するとNCoR1の異常蓄積によりエネルギー源であるケトン体*⁴の産生が低下することを見出しました。この研究成果は、オートファジーの新たな細胞生理機能の発見のみならず、代謝性疾患に代表される生活習慣病の予防や治療につながるものです。本研究成果は科学雑誌Nature Communications (2019年4月5日付)に発表されました。
本研究成果のポイント
・オートファジーによる核内受容体NCoR1の分解が脂肪酸酸化を誘導する
・オートファジー不全は脂肪酸酸化の抑制とケトン体の産生低下を引き起こす
・オートファジーの新たな細胞生理機能の発見
背景
現在、生活習慣病は健康長寿の最大の妨げとなるだけでなく、国民医療費にも大きな影響を与えています。代表的な生活習慣病の脂質異常症(高脂血症)、動脈硬化症や脂肪肝炎などの代謝性疾患は過剰な脂肪の蓄積が原因と言われています。一方、細胞成分を分解することで栄養素を細胞に供給するオートファジーが脂肪酸分解にも働くこと、そしてオートファジーが様々な生活習慣病発症を抑制することが近年明らかになりつつあります。しかしながら、オートファジーが脂肪酸代謝に働く仕組みは明らかになっていませんでした。そこで、研究グループはその仕組みを解明するため、オートファジー障害による脂質分子の変動を明らかにすることを目的に実験を行いました。
内容
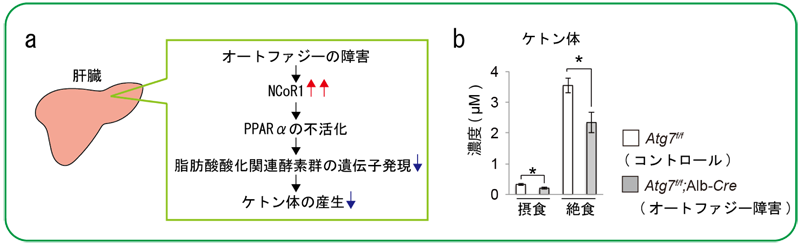
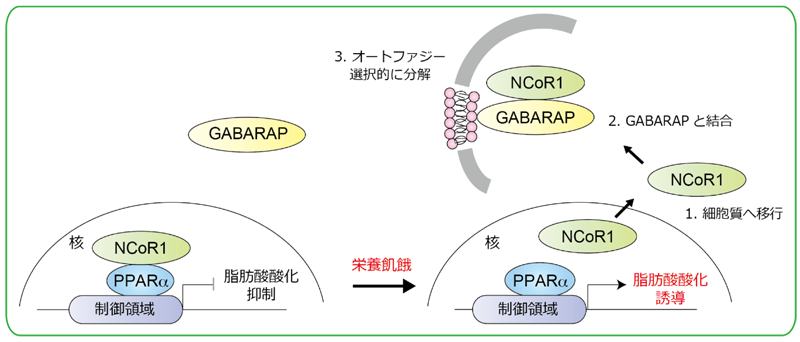
今回、研究グループは、肝臓特異的オートファジー欠損マウスを用いた詳細な生化学的、そして網羅的な脂質分子解析を行いました。その結果、オートファジー不全により、脂肪酸酸化を抑制する核内受容体コリプレッサー1(NCoR1)が蓄積し、その結果として脂肪酸酸化が顕著に抑制されることを発見しました。つまり、NCoR1が栄養飢餓に応じて「オートファゴソーム」という膜構造体に局在するGABARAPと特異的に結合し、オートファジー依存的に分解されることを見出しました。そこで、オートファジーによるNCoR1の分解の意義を検討するため、マウスの肝臓においてオートファジー必須遺伝子Atg7を欠失させた結果、NCoR1が肝臓に過剰に蓄積し、マスター転写因子であるペルオキシソーム増殖剤活性化受容体α(PPARα)*⁵が抑制されることを確認しました。さらに、肝臓特異的Atg7欠損マウスは、栄養飢餓に応じた脂肪酸酸化関連遺伝子群の遺伝子発現やエネルギー源のケトン体産生を著しく低下させることも確認しました(図1)。すなわち、栄養飢餓に応じてNCoR1がオートファジー依存的に分解されることにより効率的にPPARαが活性化し、脂肪酸酸化が促進されることを意味します(図2)。
以上の結果から、オートファジーによる新たな細胞生理機能が明らかになりました。オートファジーは単にアミノ酸、グルコース、脂肪酸などの栄養素を細胞に供給するだけでなく、それらを効率的に使用するためにも機能していることが初めて実証された研究成果と言えます。
今後の展開
本研究成果の特徴は、現在、国内外で未曾有の発展を遂げているオートファジー研究の中でも、選択的オートファジーによる細胞生理機能、特にオートファジーによるNCoR1の分解に焦点を当てたことにあります。今回の研究から、オートファジーが単に脂質を分解するだけでなく、その分解産物である脂肪酸の代謝をも促進することで、効率的な脂質代謝を可能にしていることが分かりました。一方、過剰な脂肪の蓄積が原因である生活習慣病(脂質異常症、動脈硬化症、脂肪肝炎などの代謝性疾患) においてオートファジーの抑制が指摘されており、脂質代謝の低下が強く示唆されます。したがって、オートファジーの活性化がこれら生活習慣病の効率的な予防、治療を可能にできると考えられます。
図1 オートファジー障害による脂肪酸酸化異常がもたらすケトン体の産生低下
a. オートファジー障害による脂質代謝異常のメカニズム。オートファジーの障害によりNCoR1の分解が抑制されると転写因子PPARαが抑制される。その結果、脂肪酸酸化に関与する多くの酵素の発現が抑制される。そのため、エネルギー源であるケトン体の産生が低下する。
b. オートファジーが抑制された肝臓では栄養飢餓に応じたケトン体の産生が低下する。
図2 本研究で明らかになった選択的オートファジーによるNCoR1分解メカニズム
①栄養飢餓に応じてNCoR1は核内から細胞質へ移行し、②オートファゴソームのGABARAPと結合する。 ③NCoR1はGABARAPとの結合依存的にオートファジーにより分解される。その結果、マスター転写因子のPPARαの活性化による脂肪酸酸化関連酵素の遺伝子発現が誘導され、脂肪酸酸化が促進される。
用語解説
*1. オートファジー
栄養飢餓により著しく誘導され、細胞成分を分解し、エネルギー産生のための栄養素の一つである脂肪酸を細胞に供給します。最近オートファジーが特定のたんぱく質、障害を受けた細胞小器官、あるいは細胞内に侵入した細菌などを選択的に認識・分解することが続々と明らかになり、選択的オートファジーの生理機能に注目が集まっています。
*2. 脂肪酸酸化(β酸化)
身体のなかで必要なエネルギーの大半を産生する代謝経路です。活性化された脂肪酸である脂肪酸アシル化補酵素Aの中の炭素を二つずつ切断し、アセチル補酵素Aを生産します。
*3. 核内受容体コリプレッサー1(NCoR1)
核内受容体とヒストン脱アセチル化酵素に結合し、ヒストンの脱アセチル化を促進することで遺伝子発現を抑制しています。
* 4. ケトン体
アセト酢酸、3-ヒドロキシ酪酸、アセトンの総称です。脂肪酸酸化で産生されたアセチルCoAから生成され血液に乗って、飢餓時における脳や心臓の栄養源となります。
* 5. ペルオキシソーム増殖剤活性化受容体α(PPARα)
核内受容体の1つです。遊離脂肪酸などに結合し、脂肪酸酸化に関わる酵素群の遺伝子発現を誘導するマスター転写因子です。
原著論文
本研究は、Nature Publishing Groupの
「Nature Communications」(https://www.nature.com/ncomms/)オンライン版に2019年4月5日付で公開されました。
英文タイトル: Autophagy regulates lipid metabolism through selective turnover of NCoR1
日本語訳: オートファジーはNCoR1の選択的分解を介して脂肪酸代謝を制御する
著者:Tetsuya Saito¹, Akiko Kuma²,³,⁴, Yuki Sugiura⁴,⁵, Yoshinobu Ichimura¹, Miki Obata¹, Hiroshi Kitamura⁶, Shujiro Okuda⁷, Hyeon-Cheol Lee⁸, Kazutaka Ikeda⁹, Yumi Kanegae¹⁰, Izumu Saito¹¹†, Johan Auwerx¹², Hozumi Motohashi⁶, Makoto Suematsu⁵, Tomoyoshi Soga¹³, Takehiko Yokomizo⁸, Satoshi Waguri¹⁴, Noboru Mizushima², and Masaaki Komatsu¹,¹⁵
著者(日本語表記):齊藤哲也¹、久万亜紀子²,³,⁴、杉浦悠毅⁴,⁵、一村義信¹、北村大志⁶、小幡美貴¹、奥田修二郎⁷、李賢竽⁸、池田和貴⁹、鐘ヶ江裕美¹⁰、斎藤泉¹¹,†、Johan Auwerx¹²、本橋ほづみ⁶、末松誠⁵、曽我朋義¹³、横溝岳彦⁸、和栗聡¹⁴、水島昇²、小松雅明¹,¹⁵
所属 1.新潟大学大学院医歯学総合研究科分子生物学分野、2.東京大学大学院医学研究科分子生物学分野、3.大阪大学大学院医学研究科遺伝学教室、4.JST戦略的創造研究推進事業 (さきがけ) 、5.慶應義塾大学医学部医化学学教室、6.東北大学加齢医学研究所加齢制御研究部門、7.新潟大学大学院医歯学総合研究科バイオインフォマーティックス分野、8.順天堂大学大学院医学研究科生化学・細胞機能制御学、9.理化学研究所生命医科学研究センターメタボローム研究チーム、10.東京慈恵会医科大学基盤研究施設(分子遺伝学)、11.東京大学医科学研究所遺伝子解析施設、12.Laboratory of Integrative and Systems Physiology, École Polytechnique Fédérale de Lausanne (EPFL)、13.慶應義塾大学先端生命科学研究所メタボローム研究グループ、14.福島県立医科大学解剖・組織学講座、15.順天堂大学大学院医学研究科器官・細胞生理学、†微生物化学研究所第3生物活性研究部
DOI: 10.1038/s41467-019-08829-3.
本研究は、文部科学省JSPS科研費(特別研究員奨励費 JP17J05623、新学術領域研究JP25111006、基盤研究JP15H06600 )、日本学術振興会A3フォーサイト事業、武田科学振興財団などの支援を受け実施されました。
研究内容に関するお問い合せ先
順天堂大学大学院医学研究科 器官・細胞生理学
教授 小松雅明(こまつ まさあき)
E-mail:mkomatsu@juntendo.ac.jp