がんの悪性化における窒素代謝の変化を解明 −難治性がんの新たな治療標的PPATを発見−
九州大学生体防御医学研究所の中山 敬一 主幹教授、医学系学府博士課程4年の小玉 学 大学院生と新潟大学大学院医歯学総合研究科の松本 雅記 教授らの研究グループは、次世代プロテオミクス技術であるiMPAQTシステム(※1)を駆使したがん代謝解析から、悪性のがんではグルタミン由来の窒素をDNAの合成に利用するための代謝系が亢進していること(窒素シフト)を明らかにしました。
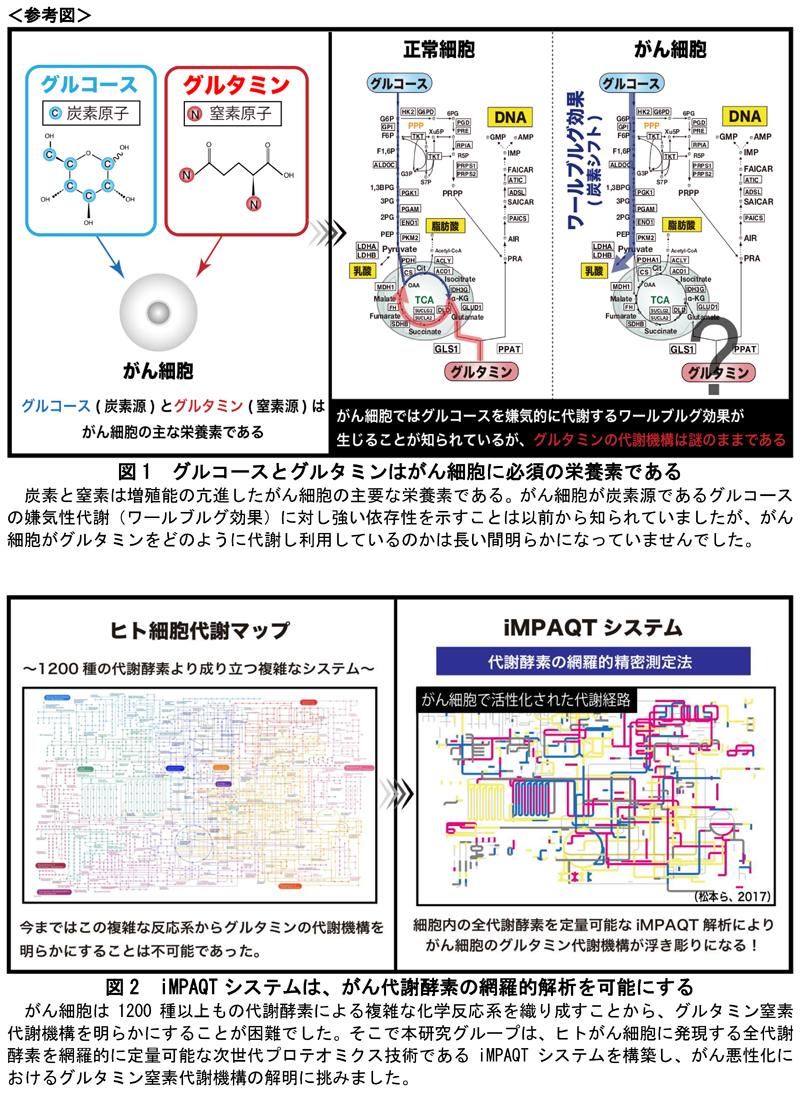
炭素と窒素は生体の主要な構成要素であり、それぞれ主にグルコースとグルタミンという二大栄養素から供給されます。がん細胞では炭素源であるグルコースを嫌気的に代謝する「ワールブルグ効果」が亢進していること(炭素シフト)が約100年前から知られていました。一方で、がん細胞は盛んに増殖しているので、窒素を含むDNAを多量に作る必要がありますが、今まではがん細胞がどのようにグルタミンからDNAに窒素を効率よく配分しているのかは不明でした。
そこで本研究グループは、独自に開発したiMPAQTシステムを用いて、がん細胞の悪性化に伴う代謝酵素の発現変化を追跡しました。その結果、悪性化したがん細胞では、グルタミンの窒素をDNAの前駆体に転移するPPAT(※2)という代謝酵素が高発現しており、それによって生じるグルタミンからの窒素代謝シフトが、がんの悪性化の過程に必須であることを明らかにしました。更に公共データベース(※3)に登録されている11,000人のがん患者のメタアナリシス(※4)から、PPATが約1200種のヒト全代謝酵素の中で最もがん患者の死亡リスクを高める因子であり、特に小細胞肺がん(※5)をはじめとした難治性がんを治療する上で有望な標的になることを世界に先駆けて発見しました。これらの成果は、現在治療が困難とされている小細胞肺がんをはじめとした難治性がんに対して、PPATの阻害薬(現在開発中)が効果的な治療法となる可能性を示しています。本研究成果は、2020年3月17日(火)(米国東部時間)に英国科学雑誌「Nature Communications」で公開されました。
研究者からひとこと
悪性化したがん細胞はPPATを発現上昇させることでグルタミンの窒素からDNAを効率的に合成します。このPPATの反応を阻害することで、がん細胞の増殖を効果的に抑制できることから、今まで治療困難であった難治性がんの新規治療法となる可能性が示唆されます。
<研究の背景と経緯>
炭素と窒素は生体の主要な構成要素です(図1)。細胞は炭素源としてグルコースを、窒素源としてグルタミンを必須の栄養素として取り込んでいます。特にがん細胞では、炭素源であるグルコースの嫌気性代謝に対し強い依存性を示すことが約100年も前から知られており、この現象は発見者の名前に因んでワールブルグ効果(炭素シフト)と呼ばれてきました。一方で、がん細胞は窒素源としてのグルタミンにも非常に強い依存性を示しますが、がん細胞がグルタミンの窒素をどのように代謝し利用しているのかは長い間明らかになっていませんでした。
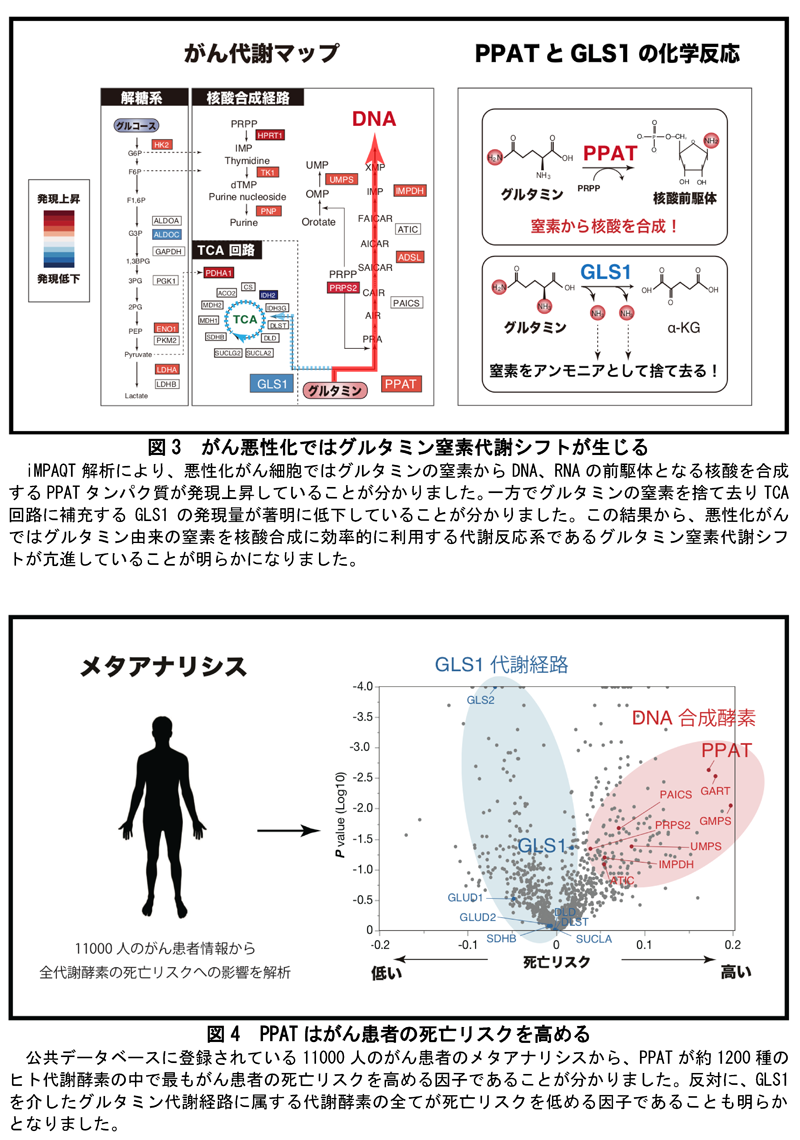
そこで本研究グループは、独自で開発した次世代プロテオミクス技術「iMPAQTシステム」を用いて、がん細胞に発現する全ての代謝酵素を一斉に測定し、がんの悪性化におけるグルタミンからの窒素代謝機構の解明に挑みました(図2)。
<研究の内容>
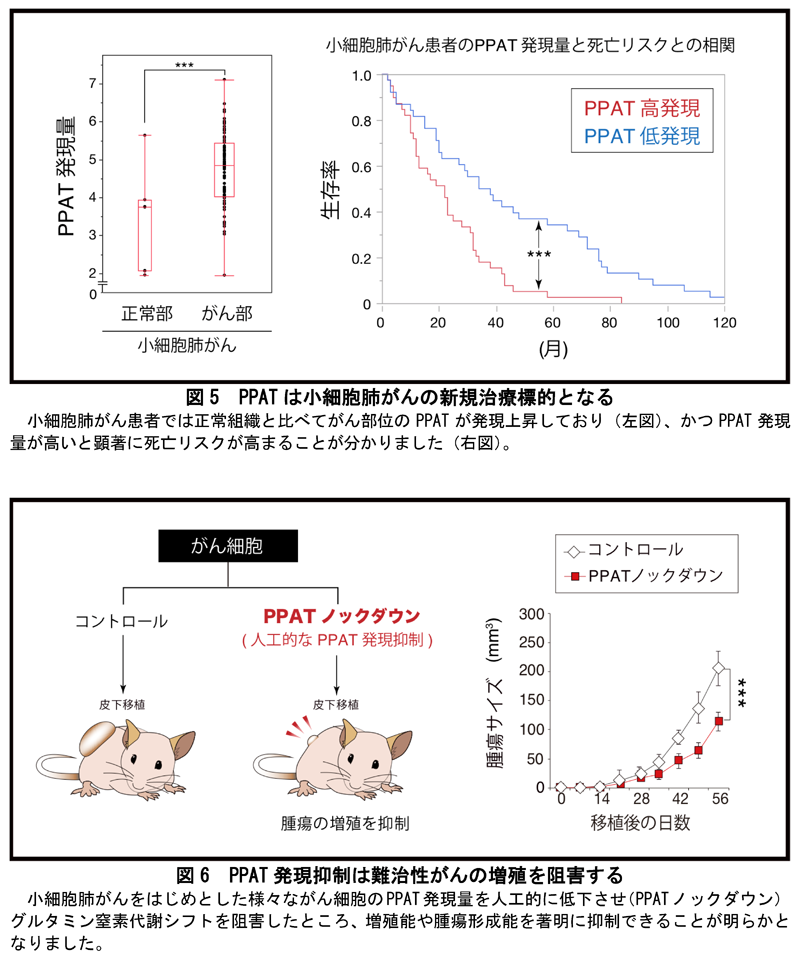
本研究グループは、iMPAQTシステムを用いて、発がん初期段階の前がん細胞と、悪性化したがん細胞における代謝酵素の発現量比較解析を行いました(図3)。その結果、悪性化したがん細胞では解糖系代謝酵素の発現上昇が確認され、ワールブルグ効果(炭素シフト)が亢進していることが分かりました。それに加えて、悪性化したがん細胞ではDNAを合成する代謝酵素群の発現が上昇しており、その中でもグルタミンの窒素を核酸前駆体に転移させるPPATという代謝酵素の発現量が著明に増加していました。逆に、グルタミンの窒素をアンモニアにして体外に排出する作用を持つグルタミナーゼ(GLS1)という代謝酵素の発現量は著明に低下していることが分かりました。これらの結果から、悪性化したがん細胞では、増殖に必須なDNAを効率的に合成するため、PPATによりグルタミン窒素をDNA前駆体に転移させる反応を亢進させる一方で、グルタミンの窒素を利用せずに体外に排出するGLS1の反応を抑えるという、大きな窒素代謝シフトが生じていることが分かりました(図3)。
次に、この悪性化したがん細胞におけるグルタミンの窒素代謝シフトが、実際のがん患者の予後にも反映される普遍的な現象であるか証明するため、公共データベースに登録されている11000人のがん患者データを統合解析するメタアナリシスを行いました(図4)。その結果、PPATが約1200種の代謝酵素の中でも、最もがん患者の死亡リスクを高める因子であることが分かりました。反対に、GLS1を介したグルタミン代謝経路に属する代謝酵素の全てが死亡リスクを低める因子であることも明らかとなりました(図4)。この結果から、グルタミンの窒素代謝シフトががんの悪性化に必須であり、かつ普遍的な現象であることが明確になりました。
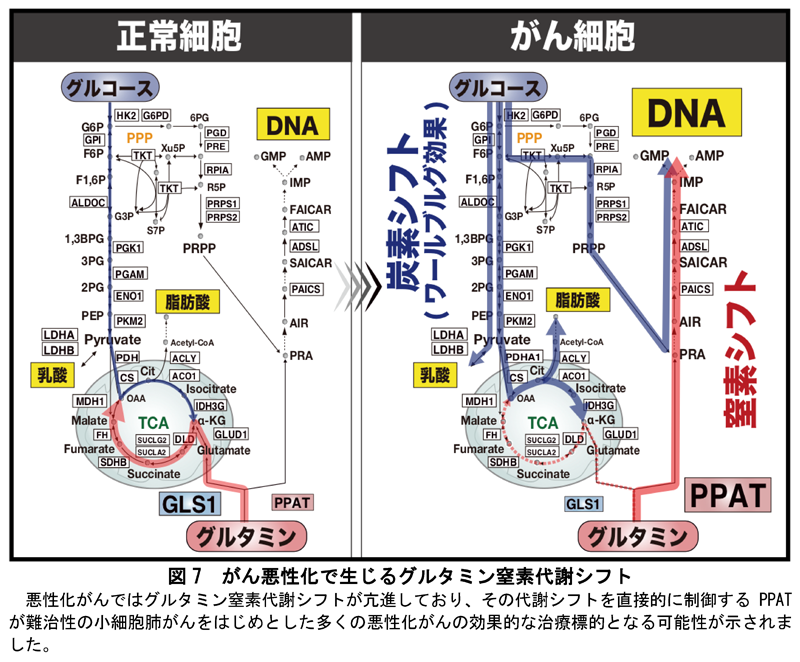
この傾向は、難治性であり効果的治療法が確立されていない「小細胞肺がん」において、最も顕著に認められました。つまり、小細胞肺がん患者では正常組織よりもがん部位でPPATの発現量が著明に上昇していることが明らかになりました(図5)。また小細胞肺がん患者では、がん部位のPPAT発現量が高いほど、死亡リスクが高くなることも確認されました(図5)。
そこで、小細胞肺がんをはじめとした多くのがん種のPPAT発現量を人工的に低下させると、グルタミンの窒素代謝シフトが阻害され、それらがん細胞の増殖能や腫瘍形成能を著明に抑制できることが明らかとなりました(図6)。これらの結果から、将来的にはPPAT阻害剤(現在開発中)によってグルタミンの窒素代謝シフトを抑制することにより、難治性がんが効果的に治療できるようになると考えられます(図7)。
<今後の展開と治療応用への期待>
現在、本研究グループは、大規模なPPAT阻害剤の探索を行っております。今後PPAT阻害剤が開発されることにより、小細胞肺がんを代表とした難治性がんに対する新規治療法の確立が期待されます。
<用語解説>
(※1)iMPAQT システム(in vitro proteome-assisted MRM for Protein Absolute QuanTification):
ヒト細胞に発現する約18000種類のタンパク質の絶対定量を可能とした質量分析システム。iMPAQT システムによりがん細胞に発現する約1200種の全代謝酵素の定量も可能となります。
(※2)PPAT (ホスホリボシルピロフォスファテートアミドトランスフェラーゼ):
細胞の増殖に必須のDNAやRNAのもととなる核酸を合成する代謝酵素。また核酸合成の第一段階の反応を担う律速酵素でもあります。
(※3)公共データベース:
公共利用が認められたがん患者データを多数登録しているデータベース。
(※4)メタアナリシス:
過去に公表された多数のがん患者データを統合し、包括的に解析する方法。大規模なデータを包括的に解析することにより、高い解析精度と結果の再現性が得られます。
(※5)小細胞肺がん:
非常に予後が悪く、特異的治療法が未確立であることから治療困難とされているがん種。
<論文名>
“A shift in glutamine nitrogen metabolism contributes to the malignant progression of cancer”
(グルタミン由来窒素代謝シフトはヒトがんの悪性化に寄与する)
Nature Communications, 2020
本成果は、以下の事業・研究領域・研究課題によって得られました。
科学研究費補助金・特別推進研究
研究課題名:「幹細胞における細胞周期の制御と代謝系との連関に関する総合的研究」
研究代表者:中山 敬一(九州大学 生体防御医学研究所 主幹教授)
研究期間:平成30年4月〜令和5年3月
本件に関するお問い合わせ先
中山 敬一(なかやま けいいち)
九州大学 生体防御医学研究所 主幹教授
E-mail:nakayak1@bioreg.kyushu-u.ac.jp
松本 雅記(まつもと まさき)
新潟大学大学院医歯学総合研究科オミクス生物学分野 教授
E-mail:masakim@med.niigata-u.ac.jp