オートファジーによるミトコンドリアの分解を促進する新しい因子を発見
新潟大学大学院医歯学総合研究科機能制御学分野の福田智行准教授、神吉智丈教授らのグループは、ミトコンドリアに存在するAtg43というタンパク質が、オートファジー(1)によるミトコンドリアの分解(以下、マイトファジー)を促進することを発見しました。マイトファジーは、機能の低下したミトコンドリアを分解することで、細胞の健全性を維持しています。本研究は、マイトファジーのメカニズムの一部と細胞内での役割を解明するとともに、ミトコンドリアの機能低下が原因となる様々な疾患の予防・治療に繋がる重要な成果といえます。
【本研究成果のポイント】
・Atg43はマイトファジーに不可欠なタンパク質である。
・Atg43はミトコンドリアの外縁に存在し、マイトファジーの際にミトコンドリアが膜に包まれる過程を促進する。
・Atg43が欠損してマイトファジーができない細胞は、栄養が乏しい環境で生存できない。
Ⅰ.研究の背景
ミトコンドリアは細胞に必要なエネルギーの大半を産生します。エネルギーと同時に発生する活性酸素は、ミトコンドリア自身や他の細胞成分を損傷してしまいます。さらに、損傷したミトコンドリアからはより多くの活性酸素が発生するという悪循環が生じます。ミトコンドリアを膜で取り囲んで分解する特別なオートファジー(マイトファジー)は、損傷したミトコンドリアを除去することで、健全な細胞を維持しています。マイトファジーは、酵母のような単細胞生物からヒトを含む高等生物まで、様々な生物に共通してみられる重要な生命現象です。ヒトでマイトファジーが欠損すると、細胞内に機能の低下したミトコンドリアが蓄積し、老化や神経変性疾患(2)が引き起こされます。そこで、マイトファジーのメカニズムや細胞内での役割の解明は、ミトコンドリア関連疾患の予防や治療に繋がると期待され、様々な生物種やモデルを用いてマイトファジーの研究が行われています。
Ⅱ.研究の概要
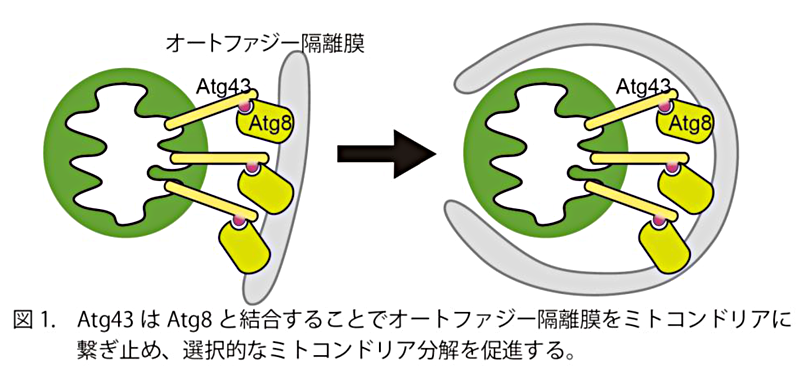
本研究グループは分裂酵母(3)を用いてマイトファジーに不可欠な因子を探索し、Atg43というタンパク質を発見しました。観察の結果、Atg43はミトコンドリアの外縁に存在していることが分かりました。また、マイトファジーの際に膜がミトコンドリアを包み込む過程で、この膜上に存在するAtg8というタンパク質にAtg43が結合することが分かりました。さらに、遺伝子操作によりAtg8がミトコンドリアと直接結合できるようにすると、Atg43の機能が欠損した細胞でもマイトファジーを生じさせることに成功しました。したがって、ミトコンドリア上のAtg43と膜上のAtg8が結合することで、膜の伸長がミトコンドリア上で安定して進行し、膜がミトコンドリアを効率よく包むことができると考えられます(図1)。加えて、Atg43の機能が欠損してマイトファジーが生じなくなると、栄養飢餓の際にミトコンドリアが正常に機能しておらず、細胞の生存も維持できなくなることが分かりました(図2)。以上の研究結果から、マイトファジーのメカニズムの一部と、マイトファジーが細胞内で果たす役割の一端を明らかにすることができました。
Ⅲ.研究の成果
分裂酵母でマイトファジーを検出する実験系を確立し、マイトファジーができなくなる遺伝子変異体を探索しました。探索の結果、マイトファジーに不可欠なタンパク質を発見し、Atg43と名付けました。Atg43の機能が欠損した細胞では、オートファジーによるミトコンドリアの分解が全く生じない一方で、ミトコンドリア以外の細胞成分の分解は正常に起きていました。したがって、Atg43はミトコンドリアの分解に特異的に必要な因子であるといえます。
顕微鏡観察と生化学的な解析から、Atg43はミトコンドリアの外縁に存在していることが分かりました。また、Atg43はAtg8というタンパク質と直接結合できることが分かりました。Atg8は、オートファジーの際に分解対象を包む膜の表面に存在しています。したがって、Atg43はAtg8との結合を介して、伸長する膜をミトコンドリア上につなぎとめていると考えられます。次に、Atg43タンパク質から、ミトコンドリアの外縁に存在するために必要な領域と、Atg8との結合に必要な領域とを、それぞれ同定しました。遺伝子操作により、これらの領域をそれぞれ欠失したAtg43を発現する細胞のマイトファジーを観察したところ、いずれもマイトファジーを促進する能力を失っていました。一方で、これら以外の領域はマイトファジーに必要ないことも明らかにしました。さらに、遺伝子操作によりAtg8がミトコンドリアと直接結合できるようにすると、Atg43の機能が欠損した細胞でもマイトファジーが生じました。以上から、ミトコンドリアの外縁に存在するAtg43は伸長する膜をミトコンドリア上につなぎとめることで、ミトコンドリアが安定して膜に包み込まれるようにしていることが分かりました(図1)。
Atg43の機能が欠損した細胞を利用することで、マイトファジーができないとどのような不都合が生じるかについても検証しました。その結果、マイトファジーが生じない細胞は、栄養が豊富な環境では正常に増殖するものの、栄養飢餓条件ではミトコンドリアが正常に機能しておらず、細胞の生存も維持できなくなっていることが分かりました。したがって、マイトファジーは栄養飢餓に際した細胞の健全性を維持するために重要であるといえます(図2)。
Ⅳ.今後の展開
本研究により、マイトファジーにおいてAtg43はミトコンドリアが膜に包み込まれる過程を促進することが分かりました。一方、Atg43はミトコンドリア上にまんべんなく存在しているため、ミトコンドリアの中から膜に包まれる領域がどのように決定するか、決定の過程にAtg43が関与しているかどうかは分かっていません。今後は分解領域がどのようにして決められているかを明らかにすることで、マイトファジーのメカニズムの全貌解明を目指します。また、Atg43の機能が欠損した細胞を様々な条件下で観察し、マイトファジーの欠損がどういった環境においてどのような異常を引き起こすのかを解析することで、マイトファジーが細胞内で担う役割についてもより一層明らかにすることが可能です。
ヒト細胞にはマイトファジーレセプターと呼ばれるタンパク質が複数存在しており、いずれもミトコンドリアの外縁に存在してAtg8に相当するタンパク質と結合することが知られています。こうしたヒトのマイトファジーレセプターと分裂酵母のAtg43との間にタンパク質としての相同性はないものの、いずれも同じ機能を果たしていると予想されます。そこで、それぞれの研究から得られる知見を統合することで、マイトファジーのメカニズムについてより深い理解が得られます。また、ヒト細胞においてもAtg8に相当するタンパク質をミトコンドリアに直接結合させることでマイトファジーが促進できるかどうかを検証したいと考えています。もし、ヒト細胞でもマイトファジーが促進できれば、マイトファジー不全が引き起こす老化や神経変性疾患の治療法の確立に貢献することが期待できます。
Ⅴ.研究成果の公表
これらの研究成果は、2020年11月3日、eLife誌(IF 7.080)に掲載されました。
論文タイトル:Atg43 tethers isolation membranes to mitochondria to promote starvation-induced mitophagy in fission yeast (Atg43は隔離膜をミトコンドリアにつなぎとめることで分裂酵母の飢餓時に誘導されるマイトファジーを促進する)
著者:Tomoyuki Fukuda, Yuki Ebi, Tetsu Saigusa, Kentaro Furukawa, Shun-ichi Yamashita, Keiichi Inoue, Daiki Kobayashi, Yutaka Yoshida, and Tomotake Kanki (福田智行、海老優樹、三枝徹、古川健太郎、山下俊一、井上敬一、小林大記、吉田豊、神吉智丈)
doi: 10.7554/eLife.61245(https://elifesciences.org/articles/61245)
Ⅵ.本研究への支援
本研究は、JSPS新学術領域研究「マルチモードオートファジー:多彩な経路と選択性が織り成す自己分解系の理解」19H05712、新学術領域研究「細胞機能を司るオルガネラ・ゾーンの解読」18H04858、挑戦的研究(萌芽) 19K22419、基盤研究(C) 17K07330・20K06552、武田科学振興財団およびAMED革新的先端研究開発支援事業PRIME「全ライフコースを対象とした個体の機能低下機構の解明」20gm6110013h0003の支援を受けて行われました。
●用語の解説
(1)オートファジー:細胞内で新たに作り出された脂質の膜が伸長し、細胞成分を包み込むように球状の構造が形成されます。膜に包まれた成分は分解酵素によって低分子へと分解されます。この一連の反応をオートファジーと呼びます。オートファジーはタンパク質をアミノ酸に分解して栄養として再利用するだけでなく、ミトコンドリアや小胞体のような細胞小器官を分解することで、その質や量を調節しています。細胞小器官のような比較的大きな細胞成分を包み込んで分解するためには、それぞれに特異的なメカニズムが存在しています。
(2)神経変性疾患:神経細胞内に本来は除去されるべき異常な細胞成分が蓄積し、神経細胞が脱落して神経系の機能が欠損する病気。アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)など。マイトファジーを担う因子の機能低下がパーキンソン病を引き起こすことが明らかにされています。
(3)分裂酵母:分裂により増殖する酵母。真核生物のモデル細胞として利用される酵母には、分裂酵母の他に出芽により増殖する出芽酵母もあります。出芽酵母はパン、ビール、日本酒などの発酵過程にも利用されています。一方、分裂酵母は主に基礎研究に用いられており、細胞増殖をはじめとする多様な生命現象のメカニズムの解明に貢献しています。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科機能制御学分野
教授 神吉智丈(かんき ともたけ)
E-mail:kanki@med.niigata-u.ac.jp