ミトコンドリアオートファジーの制御機構を解明
新潟大学大学院医歯学総合研究科機能制御学分野の大学院生Aleksei Innokentev(アレクセイ インノケンチエフ)、古川 健太郎特任助教、神吉 智丈教授らの研究グループは、Far複合体(注1)と呼ばれる因子を介したミトコンドリアオートファジー(注2)(以下、マイトファジー)の制御機構を解明しました。マイトファジーは、傷害を受けたあるいは余剰に存在するミトコンドリアを分解することで、ミトコンドリアの恒常性を維持する重要な細胞品質管理機構です。本研究は、マイトファジー制御機構の全容解明へ新たな道を拓き、老化やミトコンドリア機能低下が関わる様々な疾患の予防・治療の糸口となる成果です。
【本研究成果のポイント】
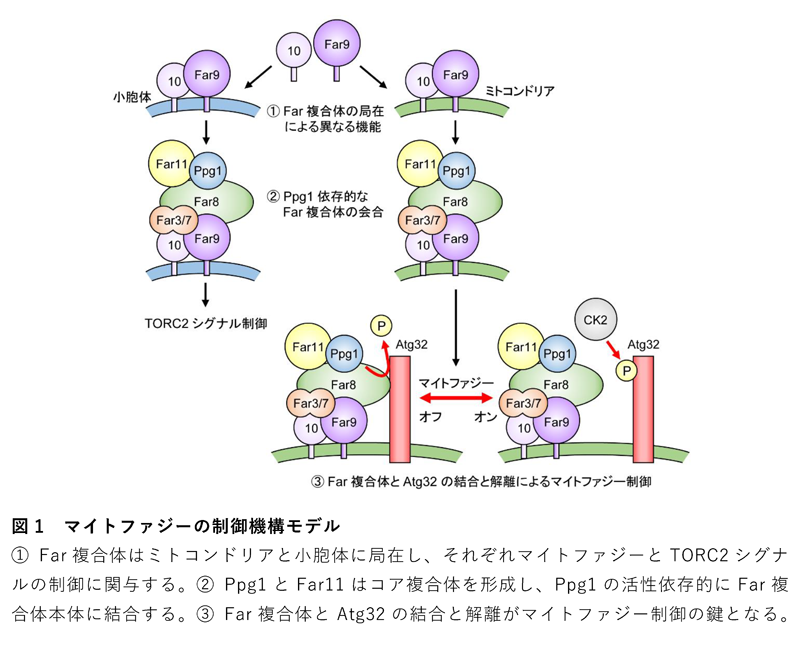
・Far複合体は、ミトコンドリアと小胞体の両方に存在し、前者はマイトファジーの制御に関与し、後者は栄養シグナル伝達経路に関与するという機能の使い分けをしている。
・脱リン酸化酵素Ppg1は、マイトファジーレセプター(注3)Atg32の脱リン酸化(注4)だけでなく、Far複合体全体の会合にも重要である。
・Far複合体のうちFar8がAtg32と直接結合し、これらの結合と解離の状態変化がマイトファジー制御の鍵である。
Ⅰ.研究の背景
ミトコンドリアは、細胞が必要とするエネルギーの大半を産生する細胞内小器官で、生命活動を行う上で非常に重要な役割を果たしています。エネルギー産生の過程で傷ついたミトコンドリアは細胞にとって有害であり、ミトコンドリアのみを標的とするオートファジー (以下、マイトファジー) によって除去される必要があります。マイトファジーの機能が破綻し、細胞内に不良ミトコンドリアが蓄積すると、神経変性疾患(注5)や老化現象などの要因となります。マイトファジーは、ミトコンドリア関連疾患治療の糸口として注目されており、酵母からヒトまで多岐に渡るマイトファジーの分子機構と生理的意義の全容解明は急務となっています。
本研究グループでは、酵母をマイトファジーのモデル生物として用いて、マイトファジーのレセプターとして機能するAtg32の同定 (Kankiら、Dev Cell、2009) を皮切りに、マイトファジーの分子機構の大部分を明らかにしてきました。特に重要な分子機構として、Atg32がカゼインキナーゼ2 (以下、CK2) という酵素によってリン酸化(注4)されることがマイトファジーの引き金となること (Kankiら、EMBO Rep、2013)、逆に、Atg32がPpg1という酵素によって脱リン酸化されることがマイトファジーの抑制につながること (Furukawaら、Cell Rep、2018) を発表しました。Ppg1は、Far3-7-8-9-10-11の6つのタンパク質から構成されるFar複合体と協調して機能することも見出していましたが、実際にAtg32のリン酸化と脱リン酸化がどのように制御されているのかは不明のままでした。本研究では、Far複合体に着目して研究を進めました。
Ⅱ.研究の概要と成果
過去の報告では、Far複合体は小胞体という細胞内小器官に局在すると考えられていたため、ミトコンドリアに局在するAtg32の脱リン酸化がFar複合体によってどのように制御されるのかという疑問が残っていました。Far複合体因子に蛍光タンパク質を融合させ、蛍光顕微鏡を用いた詳細な局在解析を行ったところ、Far複合体は小胞体だけではなくミトコンドリアにも局在していること、その局在にFar9とFar10の膜貫通領域が重要であることが分かりました。次に、小胞体あるいはミトコンドリアの一方にのみ局在するようにFar9の膜貫通領域を遺伝子改変し、局在パターンと機能の違いを調べました。その結果、ミトコンドリア型Far複合体はマイトファジーの制御に関与し、小胞体型Far複合体はTORC2という栄養シグナル伝達経路の制御に関与するという局在による機能の使い分けをしていることが明らかとなりました。
次に、Far複合体構成因子をすべて欠損させた酵母に、各Far因子を一つずつ戻し、免疫沈降法という手法を用いてPpg1と優先的に結合するFar因子を調べました。その結果、Ppg1とFar11は他のFar因子非依存的にサブ複合体を形成し、Far8を中心とするFar複合体本体 (Far3-7-8-9-10) へと結合することが分かりました。また、サブ複合体と本体の結合にはPpg1の活性自体が必須であり、Ppg1はAtg32の脱リン酸化だけではなく、Far複合体全体の会合にも重要な役割を果たすことが明らかとなりました。
本研究の開始当初は、マイトファジーの誘導条件下ではPpg1とFar複合体の結合状態が崩れることによってAtg32の脱リン酸化ができなくなり、その結果としてCK2によるAtg32のリン酸化が促進されると予想しました。しかしながら、予想に反し、Ppg1とFar複合体の結合状態、Far因子間の結合状態、Far複合体の局在などはマイトファジー誘導時にも変化しなかったことから、他の要因が考えられました。さらなる解析を進めた結果、Far複合体の中でもFar8がAtg32と直接結合することや、マイトファジーの誘導条件下ではFar8とAtg32の解離が起こることを見出しました。さらに、Far8とAtg32を強制的に繋いだ変異体では、Atg32のリン酸化やマイトファジーが強く抑制されたことから、Far複合体がAtg32から解離することがマイトファジー制御の鍵であるという結論に至りました。
以上の結果をもとに、図1に示されたマイトファジーの制御機構モデルを提唱しました。本研究成果は、オートファジーやマイトファジーだけでなく、ヒトのFar複合体に相当するSTRIPAK複合体の研究分野にも多くの知見を与えることが期待されます。
Ⅲ.今後の展開
マイトファジーの誘導条件下において、Far複合体とAtg32の結合は未解明のシグナルによって阻害されると推測されます。今後は、このシグナルの正体と詳細な分子機構を明らかにすることでマイトファジーの制御機構の全容解明を目指します。
Ⅳ.研究成果の公表
これらの研究成果は、2020年12月15日、eLife誌(IMPACT FACTOR 7.080)に掲載されます。
論文タイトル:Association and dissociation between the mitochondrial Far complex and Atg32 regulate mitophagy (ミトコンドリア型Far複合体とAtg32の結合と解離がマイトファジーを制御する)
著者:Aleksei Innokentev#, Kentaro Furukawa#,*, Tomoyuki Fukuda, Tetsu Saigusa, Keiichi Inoue, Shun-ichi Yamashita, and Tomotake Kanki* (アレクセイ インノケンチエフ#、古川健太郎#,*、福田智行、三枝徹、井上敬一、山下俊一、神吉智丈*) #同等貢献、*責任著者
doi: 10.7554/eLife.63694
Ⅴ.本研究への支援
本研究は、JSPS新学術領域研究「マルチモードオートファジー:多彩な経路と選択性が織り成す自己分解系の理解」19H05712、新学術領域研究「細胞機能を司るオルガネラ・ゾーンの解読」18H04858、挑戦的研究(萌芽) 19K22419、基盤研究(B) 17H03671、基盤研究(C) 18K06129、(公財)武田科学振興財団、(公財)野田産業科学研究所、(公財)発酵研究所およびAMED革新的先端研究開発支援事業PRIME「全ライフコースを対象とした個体の機能低下機構の解明」20gm6110013h0003の支援を受けて行われました。
≪用語説明≫
(注1) Far複合体: Far3-7-8-9-10-11の6タンパク質から構成される。ヒトではSTRIPAK複合体として知られており、その欠損は様々な疾病に関連することから、近年注目を集めている。
(注2) オートファジー: 細胞質成分をオートファゴソームと呼ばれる二重膜で包み込み、液胞あるいはリソソームで分解し、栄養源の再利用や傷ついた細胞小器官を排除する生理機能である。オートファジーは、細胞質成分を非選択的に丸ごと分解するバルクオートファジー、細胞小器官や特定の酵素のみを選択的に分解する選択的オートファジーに分類され、本研究では、ミトコンドリアを選択的に分解するマイトファジーに焦点を当てている。
(注3) マイトファジーのレセプター: ミトコンドリア上に存在するマイトファジーの目印となるタンパク質。出芽酵母ではAtg32、分裂酵母ではAtg43、ヒトではNix、BNIP3、FKBP8、FUNDC1、Bcl2-L-13などが存在する。
(注4) リン酸化と脱リン酸化: 多くのタンパク質は、特定のアミノ酸 (セリン、スレオニン、チロシン) がタンパク質リン酸化酵素によってリン酸化という修飾を受けることによって、その立体構造が変化し、活性の上昇や低下あるいは他のタンパク質との結合や解離などが起こる。リン酸化されたタンパク質は、脱リン酸化酵素によって脱リン酸化される。
(注5) 神経変性疾患: 神経の変性や神経細胞死を伴う病気の総称であり、アルツハイマー病、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症(ALS)などが知られている。近年、パーキンソン病はマイトファジーの異常が原因の一つだと考えられている。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科機能制御学分野
特任助教 古川健太郎(ふるかわ けんたろう)
教授 神吉智丈(かんき ともたけ)
E-mail:furukawa@med.niigata-u.ac.jp
kanki@med.niigata-u.ac.jp