iPS細胞モデルを用いたベイジアンネットワーク解析(iBRN法)による筋萎縮性側索硬化症(ALS)の分子病因の探索
武田薬品工業株式会社の野上真宏博士、慶應義塾大学医学部生理学教室の岡野栄之教授、新潟大学大学院医歯学総合研究科脳機能形態学分野の矢野真人准教授、東北大学大学院医学系研究科神経内科の青木正志教授らの共同研究チームは、産学連携共同研究の一環である武田薬品工業株式会社湘南インキュベーションラボプロジェクトにおいて、iBRN法と名付けた、iPS細胞由来神経細胞とスーパーコンピュータを駆使したベイジアンネットワーク解析手法(注1)を用いて、家族性筋萎縮性側索硬化症(ALS)(注2)を分子レベルで解析し、病態に重要なRNA発現のネットワークで中心的な役割を果たすハブ遺伝子群の発見に成功しました。
ALSは筋萎縮と筋力低下を主症状とした運動ニューロン(注3)が選択的に侵される神経変性疾患で、その病態進行は極めて早く、有効な治療法が少ない指定難病です。本研究グループは、健常者および家族性ALSの中でもFUS遺伝子(注4)に変異を持つ患者から得たiPS細胞由来運動ニューロンの分化段階を含む60種類の細胞のトランスクリプトーム情報(注5)を基に、ベイジアンネットワーク解析を実施し、病態に関与する3つのハブ遺伝子として、PRKDC、miR-125b-5p、TIMELESSを同定しました。さらに、これらの3遺伝子に関して、PRKDCの活性は、ALSの原因遺伝子であるFUS蛋白質の異常局在に関わる事、また、miR-125b-5p−TIMELESSの分子経路は、神経変性の分子病因であるDNA損傷を引き起こす事を、細胞モデルを用いて実証しました。以上、本研究により確立したiBRN法は、神経変性疾患に対する分子病因の探索に有効性を示すと共に、幅広い原因不明な疾患の分子病因の解明へ新しい研究戦略を示唆するものです。
本研究成果は、2021年4月20日(米国西海岸時間)に、『Neurobiology of Disease』のオンライン版に掲載されました。
1.研究の背景
筋萎縮性側索硬化症(ALS)は四肢の筋力低下などの症状を呈し急速に進行する運動ニューロン変性疾患として知られており、現在有効な治療法は少なく、その病態メカニズムも明らかになっていない神経難病です。ALS患者のおよそ10%は家族歴があり、その原因遺伝子としてTARDBP、FUSを含めRNA制御因子に関する変異した遺伝子などが複数報告されていますが、その分子メカニズムについて、未解明な点が多く残されています。これまで本研究グループは、筋萎縮性側索硬化症ALSの病態解明のために、iPS細胞を用いた疾患モデルおよび薬物の作用を評価できるように実験系を開発し、運動ニューロンの生存、神経突起退縮、蛋白質凝集に対して、ALSに有効な薬物群や新たな薬物の標的分子の候補群を探索してきました(参考文献1)。さらに今回、本研究グループは、ALSに見られるRNA制御の破綻の原因、あるいはネットワークの上位で幅広くRNA発現を制御するRNA制御因子の存在の可能性を考えました。そこで、iPS細胞由来神経細胞の解析から得た膨大なトランスクリプトーム情報を基に、本研究グループの開発したiPS細胞モデルとスーパーコンピュータを駆使したベイジアン遺伝子ネットワーク解析を組み合わせたiBRN("Non- biased" Bayesian gene regulatory network analysis based on induced pluripotent stem cell (iPSC)-derived cell model)法により、病態のRNA発現で中心的な役割を果たすハブ遺伝子群を同定することで、新たなALSの病態へ迫る新規手法の有効性の確認とALSの分子経路の解明を試みました。
2.研究の概要と成果
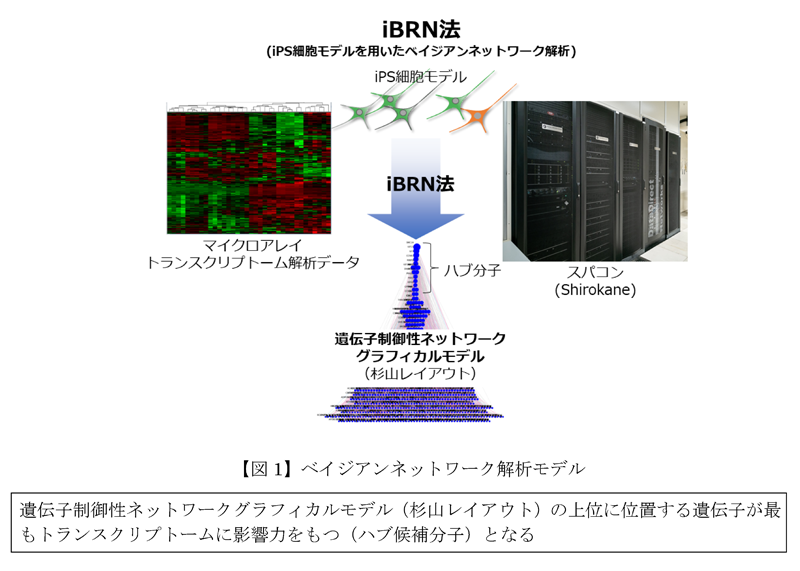
本研究グループは、健常者およびFUS遺伝子に遺伝子変異(FUSH517D)を持つALS患者由来の正常iPS細胞株と疾患iPS細胞株およびゲノム編集(注6)によって同様の遺伝子変異(FUSH517D)を持つアイソジェニックiPS細胞株を分化誘導し、幼若運動ニューロンと成熟運動ニューロンの分化段階から得られたトランスクリプトーム情報を入手しました。得られた60種類のトランスクリプトーム情報を基にスーパーコンピュータによるベイジアンネットワーク解析によって、miRNA(注7)やRNA結合蛋白質群を中心とした群間ネットワークの存在を考慮した有効非巡回グラフによる遺伝子ネットワークを可視化する解析を行いました(iBRN法:図1)。
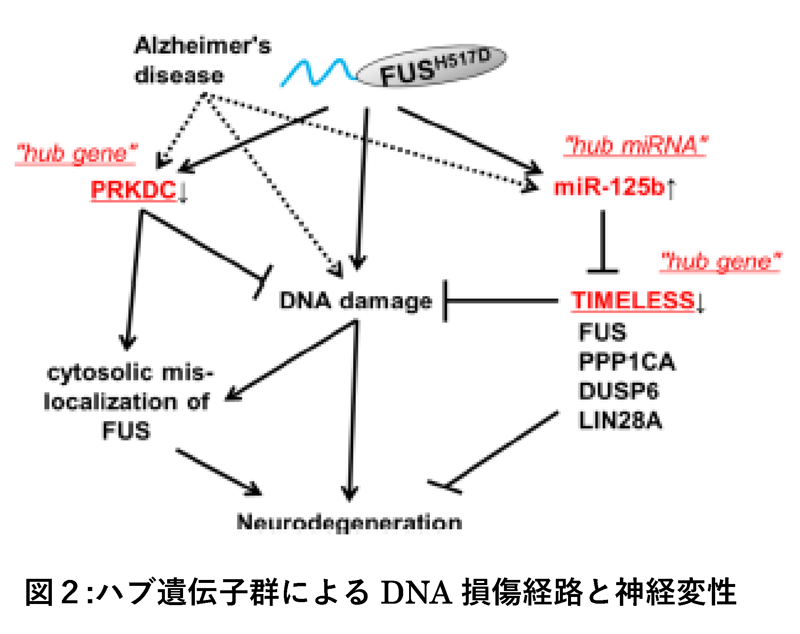
本解析では、候補の上位にあるハブ遺伝子群の中で、PRKDC、miR-125b-5p、TIMELESSに着目しました。PRKDC遺伝子は、DNA損傷応答性のDNA依存性蛋白質リン酸化酵素の触媒サブユニット(DNA-PKcs)をコードしており、既にDNA-PK はFUS蛋白質の直接のリン酸化および、FUS蛋白質の細胞質移行を制御している事が報告されています。FUSがALSの原因遺伝子であることから、今回の解析でPRKDC遺伝子とALSとの関係が明らかとなり、iBRN解析の有効性を示唆するものとなりました。加えて本研究グループは、細胞モデルの解析で、DNA損傷応答に加えてDNA-PKの活性の阻害がALSに見られるFUS蛋白質のストレス顆粒(注8)の異常凝集を導くという新しい知見も見出しました。さらに、本研究グループが新規に発見したmiR-125b-5p、TIMELESS遺伝子は、遺伝子の機能を阻害する実験によって、いずれも神経変性の原因となるDNA損傷を誘導する事が確認されると共に、遺伝子発現を負に制御するmiRNAであるmiR-125b-5p自身は、FUS遺伝子、TIMELESS遺伝子、PPP1CA遺伝子、DUSP6、LIN28A遺伝子の発現と逆の相関を示し、これらの遺伝子を直接標的とする事で、DNA損傷依存性の神経変性誘導のハブとして働いている事を細胞モデルにおいて実証するに至りました(図2)。以上の結果は、iBRN法をヒト神経変性疾患の分子病因の探索に世界で初めて用いた研究であり、近い将来、原因不明な多くの疾患の分子病因の探索における新しいプラットフォームを提供するものと期待されます。
3.今後の展開
本研究成果であるiBRN解析は、従来の生命情報を解析するバイオインフォマティクス解析では対象とならないような機能未知の非コードRNA(注9)なども含め、完全データ駆動型で遺伝子発現情報の変動に対し最も重要な遺伝子群の同定を可能とする手法となります。つまり、従来では検出不可能であったALS病態における異常等を見出すことが十分に可能であることを示唆しており、ALS病態全容解明を推し進める強力なツールとなることが期待されます。さらには、今回発見したハブ遺伝子には、ALSだけでなくアルツハイマー病と共通の経路にある遺伝子群の関与が示唆されており、本解析手法が幅広い原因不明の疾患の病因解明のツールとなる事も期待されます。
4.特記事項
本研究は、武田薬品工業湘南インキュベーションラボ2ndSILプロジェクト、武田薬品工業株式会社との共同研究費、国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「神経疾患特異的iPS細胞を活用した病態解明と新規治療法の創出を目指した研究」並びにJSPS科研費JP20H00485の支援を受けて実施されました。
5.論文について
英文タイトル:Identification of hub molecules of FUS-ALS by Bayesian gene regulatory network analysis of iPSC model: iBRN
タイトル和訳:ヒトiPS細胞モデルに基づいたベイジアン遺伝子制御ネットワーク解析戦略 iBRN法によるFUS関連家族性筋萎縮性側索硬化症の分子病因のハブ遺伝子群の同定戦略
著者名:野上真宏*、石川充、土井淳、佐野修、曽根岳史、秋山徹也、青木正志、中西淳、大儀和宏、矢野真人、岡野栄之* (*責任著者)
掲載誌:Neurobiology of Disease(オンライン版)
DOI:10.1016/j.nbd.2021.105364.
【参考文献】
1.タイトル:Modeling sporadic ALS in iPSC-derived motor neurons identifies a potential therapeutic agent.
掲載誌:Nature Medicine(オンライン版)
DOI:10.1038/s41591-018-0140-5
【用語説明】
(注1)ベイジアンネットワーク:ベイジアンネットワークは、有向非巡回グラフ(Directed Acyclic Graph: DAG)を用いて、因果関係を確率により記述するグラフィカルモデルの一つ。個々の確率変数(ノード)の関係性を、方向性を有す条件付き依存性(エッジ)により示すことで、複雑な経路を伴った因果関係をモデル化することができます。
(注2)筋萎縮性側索硬化症(ALS: amyotrophic lateral sclerosis):運動ニューロンが選択的に侵される神経変性疾患であり、年間におよそ1万人に1〜2人の確率で発症するとされ、日本にも約1万人の患者がいるとされています。多くは家族歴がありませんが、約10%は遺伝性であり複数の変異遺伝子が同定されています。現在有効な治療法は少なく、早期の治療法確立・治療薬開発が待ち望まれています。
(注3)運動ニューロン:運動ニューロンは神経の一種で、骨格筋へ伝令を送る機能を担っています。ALS患者においては運動ニューロンが選択的に変性することで運動機能が減衰していき、筋萎縮や筋力低下を呈します。
(注4)FUS遺伝子:FUS遺伝子はALSの原因遺伝子の一つであり、FUS遺伝子からコードされるFUS蛋白質は遺伝子発現調節などを行う多機能性蛋白質です。
(注5)トランスクリプトーム情報:細胞中に発現しているmRNAや非コードRNAの全ての情報の総称であり、細胞の性質や病原性因子に呼応して変動します。
(注6)ゲノム編集:ゲノム上の標的とする遺伝子の破壊や、他の遺伝子の挿入などを可能にする、遺伝子改変技術の総称です。
(注7)miRNA:21-24塩基の小分子RNAで、Argonaute(AGO)とmicroRNA induced silencing complex(miRISC)を形成し、特定の標的遺伝子のmRNAに対する相補的配列を認識する事で、遺伝子発現を抑制します。
(注8)ストレス顆粒:ストレス顆粒は、ストレス刺激に応答して一過性に形成される細胞内構造体であり、ストレスから細胞を防御する機構として考えられていますが、ALSでは異常にストレス顆粒が形成され、逆に細胞毒性を発揮してしまうと考えられています。
(注9)非コードRNA:タンパク質へと翻訳される伝令RNA(messenger RNA, mRNA)を除く全てのRNAの総称であり、リボソームRNA、転移RNAなど長い研究の歴史を持つ古典的非コードRNA群やmiRNAなどの機能性小分子RNA群、機能未知な長鎖型非コードRNA群などを指します。
※ご取材の際には、事前に下記までご一報くださいますようお願い申し上げます。
※本リリースは文部科学記者会、科学記者会、厚生労働記者会、厚生日比谷クラブ、新潟県政記者クラブ、各社科学部等に送信しております。
【本発表資料のお問い合わせ先】
慶應義塾大学医学部生理学教室
教授 岡野 栄之(おかの ひでゆき)
E-mail:hidokano@a2.keio.jp
新潟大学大学院医歯学総合研究科 脳機能形態学分野
准教授 矢野 真人(やの まさと)
E-mail:myano@med.niigata-u.ac.jp
東北大学大学院医学系研究科神経内科
教授 青木 正志(あおき まさし)
E-mail:aokim@med.tohoku.ac.jp
【本リリースの配信元】
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚
〒160-8582 東京都新宿区信濃町35
E-mail:med-koho@adst.keio.ac.jp
http://www.med.keio.ac.jp
新潟大学広報室
〒950-2181 新潟県新潟市西区五十嵐2の町8050番地
E-mail:pr-office@adm.niigata-u.ac.jp
https://www.niigata-u.ac.jp/