使われない筋肉の萎縮過程におけるオートファジーによるミトコンドリア分解の増加を発見
新潟大学大学院医歯学総合研究科機能制御学分野の山下俊一助教、井上敬一特任助教、神吉智丈教授、大正製薬株式会社Discovery研究所の久間昌尚研究員らの研究グループは、使われない骨格筋が萎縮していく過程でオートファジー(1)によるミトコンドリア分解(以下、マイトファジー)が増加することを発見しました。本研究は、骨格筋が萎縮するメカニズムの一端を明らかにするもので、現在の超高齢社会において必要な“健康寿命の延伸”につながる重要な発見といえます。
【本研究成果のポイント】
・マイトファジー活性を検出できる新たなマウスを開発
・骨格筋の萎縮過程では、マイトファジー活性は増加する
・骨格筋の萎縮過程では、マイトファジー関連遺伝子の発現も増加する
Ⅰ.研究の背景
骨格筋は使われない状態が続くと次第に萎縮します。その際ミトコンドリアから産生される活性酸素種(2)の増加が、筋肉を構成するタンパク質の分解を増加させ、萎縮を促進すると考えられています。しかしながらミトコンドリアからの活性酸素種が増加するメカニズムは明らかにされていません。本研究グループは、オートファジーによるミトコンドリア分解(マイトファジー)が低下することがその原因ではないかと考え、骨格筋の萎縮過程におけるマイトファジー活性の変化を調べました。
Ⅱ.研究の概要
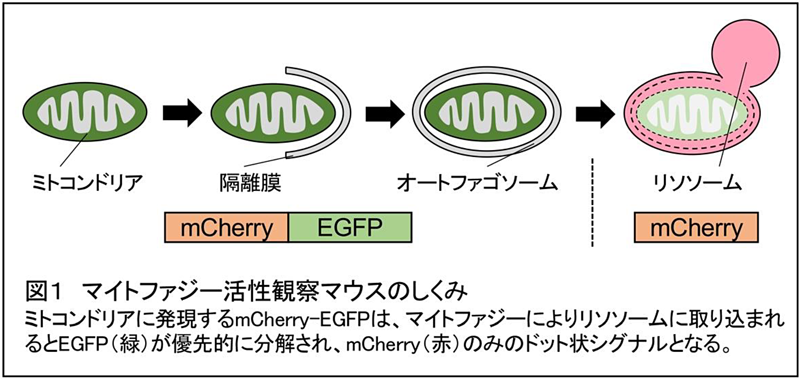
本研究では、上記の問題に対する結論を得るために、生体内で起こるマイトファジー活性を可視化できるマイトファジー活性観察マウス(以下、マイトファジー観察マウス)を新たに作製しました(図1)。このマイトファジー観察マウスは、ミトコンドリアに特異的にmCherry(赤)とEGFP(緑)を連結した蛍光タンパク質を発現しており、正常なミトコンドリアは赤と緑の2種類の蛍光を発します。一方、ミトコンドリアがオートファジーによりリソソーム(3)に運び込まれると、EGFPがmCherryに比べ優先的に分解され、マイトファジー活性は赤のみの蛍光として観察することができます。このマイトファジー観察マウスを用いて、後肢にギプス固定を施し使えなくすることで、筋萎縮を誘導し、この際に起こるマイトファジー活性の変化について検討しました。
Ⅲ.研究の成果
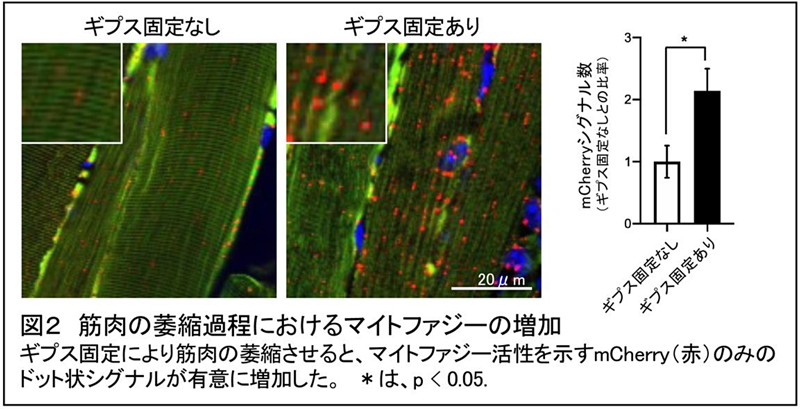
マイトファジー観察マウスの後肢をギプスで2週間固定したマウスの骨格筋(ヒラメ筋、足底筋)を取り出し、その重量を計測したところ、ギプス固定しなかったマイトファジー観察マウスに比べ有意に減少していました。またギプス固定したマウスでは、活性酸素種の増加やミトコンドリア量の減少も確認されました。さらにギプス固定したマイトファジー観察マウスの骨格筋組織のマイトファジー活性を計測したところ、ギプス固定しなかったマウスに比べ、著しく増加していることが明らかとなりました(図2)。この結果は、マイトファジーの誘導に関係する遺伝子群の発現が増加していることからも確認されました。以上の結果から本研究グループは、ギプス固定により萎縮を起こした筋組織において、マイトファジー活性が増加していると結論づけました。
Ⅳ.今後の展開
今回の研究により、筋萎縮の起こる過程において、活性酸素種の産生増加とマイトファジー活性の増加が競合的に起こっている中、活性酸素種の産生増加が相対的に多いことから筋萎縮が進行するのではないかと考えています。本研究は、骨格筋が萎縮するメカニズムの一端を明らかにするもので、現在の超高齢社会において必要な“健康寿命の延伸”につながる重要な発見といえます。今後はマイトファジー活性を阻害することで、筋萎縮の進行におけるマイトファジーの機能を明らかにするとともに、マイトファジー活性調節による筋萎縮の治療法の開発を行う予定です。
Ⅴ.研究成果の公表
これらの研究成果は、2021年5月2日、Journal of Cellular Physiology誌(IMPACT FACTOR 5.546)に掲載されました。
論文タイトル:Mitophagy reporter mouse analysis reveals increased mitophagy activity in disuse-induced muscle atrophy(マイトファジー観察マウスの解析により明らかとなった、廃用性筋萎縮時におけるマイトファジー活性の増大)
著者:Shun-Ichi Yamashita#, Masanao Kyuuma#, Keiichi Inoue#,*, Yuki Hata, Ryu Kawada, Masaki Yamabi, Yasuyuki Fujii, Junko Sakagami, Tomoyuki Fukuda, Kentaro Furukawa, Satoshi Tsukamoto, Tomotake Kanki* (山下俊一#、久間昌尚#、井上敬一#,*、畑優紀、川田竜、山火正毅、藤井康行、坂神純子、福田智行、古川健太郎、塚本智史、神吉智丈*) #同等貢献、*責任著者
doi: 10.1002/jcp.30404
Ⅵ.本研究への支援
本研究は、JSPS新学術領域研究19H05712、18H04858、18H04691、16H01198、挑戦的研究(萌芽)20K21521、基盤研究(B)20H04035、17H03671、若手研究(B)17K15088、研究活動スタート支援19K23822、国際共同研究加速基金16KK0162、武田科学振興財団、鈴木謙三記念医科学応用研究財団、花王健康科学研究会およびAMED革新的先端研究開発支援事業PRIME「全ライフコースを対象とした個体の機能低下機構の解明」18gm6110013h0001の支援を受けて行われました。
●用語の説明
(1)オートファジー:不要になったタンパク質や細胞小器官をオートファゴソームと呼ばれる二重膜で包み込み、リソソームと融合することで分解するシステム。その中でもミトコンドリアを選択的に取り込み分解するものをマイトファジーという(図1参照)。
(2)活性酸素種:酸素分子に由来する、反応性が高い分子の総称。生体内においてDNAやタンパク質などの生体分子を酸化させ、損傷を与える。ミトコンドリアでのエネルギー産生の際の副産物として産生され、活性酸素種の増加はさまざまな疾患の発症や老化の進行に関わると考えられている。
(3)リソソーム:小さな球状の細胞小器官で、内部に各種の消化酵素を含んでいる。細胞内で不要になった物質や細胞外から取り込んだ物質の分解を行う。オートファゴソームとも融合することで、オートファゴソーム内の物質の分解も行う。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科機能制御学分野
特任助教 井上 敬一(いのうえ けいいち)
E-mail:kinoue04@med.niigata-u.ac.jp
教授 神吉 智丈(かんき ともたけ)
E-mail:kanki@med.niigata-u.ac.jp