筋萎縮性側索硬化症においてTDP-43蛋白質の分解を誘導し、異常なTDP-43凝集体の形成を抑制する分子メカニズムを解明
筋萎縮性側索硬化症(Amyotrophic lateral sclerosis: ALS)は、運動神経細胞が選択的に障害され、筋萎縮と筋力低下を主症状とする致死的な神経変性疾患です。ALSの運動神経細胞では、ユビキチン化(注1)されたTDP-43蛋白質(Ub-TDP-43)(注2,3)の凝集体が形成されます。このUb-TDP-43凝集体が神経細胞に毒性を示し、ALSを発症させます。TDP-43、オプチニューリン(optineurin)(注4)、TIA1(注5)は、いずれも家族性ALSの原因遺伝子です。新潟大学大学院医歯学総合研究科ウイルス学分野の垣花太一助教、藤井雅寛教授らの研究グループは、家族性ALS由来のオプチニューリン変異体がTIA1蛋白質の発現を増加させ、このTIA1がUb-TDP-43蛋白質の分解を抑制し、Ub-TDP-43蛋白質の病的な凝集体を形成させることを明らかにしました。これらの研究から、正常なオプチニューリンはUb-TDP-43凝集体の形成を阻害するが、家族性ALS由来のオプチニューリン変異体はUb-TDP-43凝集体の形成を促進することが明らかになりました。さらに、家族性ALS由来のオプチニューリン変異体は、家族性ALSの原因遺伝子でもあるTIA1の発現を増加させることで、Ub-TDP-43の病的な凝集体形成を誘導することを明らかにしました。
【本研究成果のポイント】
・オプチニューリンはUb-TDP-43蛋白質の分解を促進し、異常なUb-TDP-43凝集体の形成を抑制する。
・家族性ALS由来のオプチニューリン変異体はUb-TDP-43蛋白質の分解を阻害し、異常な凝集体形成を促進する。
・TIA1はUb-TDP-43蛋白質の分解を抑制し、異常な凝集体形成を促進する。
・ALS関連のオプチニューリン変異体を発現させた細胞では、蓄積されたUb-TDP-43がストレス顆粒(注6)に局在し、異常な凝集体形成を開始する。
Ⅰ.研究の背景
筋萎縮性側索硬化症(ALS)は、運動神経細胞が選択的に障害され、筋萎縮と筋力低下を主症状とする致死的な神経変性疾患です。ALSの運動神経細胞では、ユビキチン化されたTDP-43蛋白質(Ub-TDP-43)の凝集体が形成され、この凝集体が神経細胞に毒性を示し、ALSを発症させます。TDP-43、オプチニューリン、TIA1は、いずれも、家族性ALSと孤発性ALS(注7)の原因遺伝子です。オプチニューリンとTIA1に変異があるALS患者の脳病変部位にも、Ub-TDP-43の凝集体が観察されており、これら3つのALS原因遺伝子が同じ分子メカニズムでALSを発症させていることが示唆されています。しかしながら、Ub-TDP-43の凝集体形成の仕組みおよび、オプチニューリンとTIA1が、どのように、TDP-43凝集体の形成を誘導するのかは不明でした。
Ⅱ.研究の概要
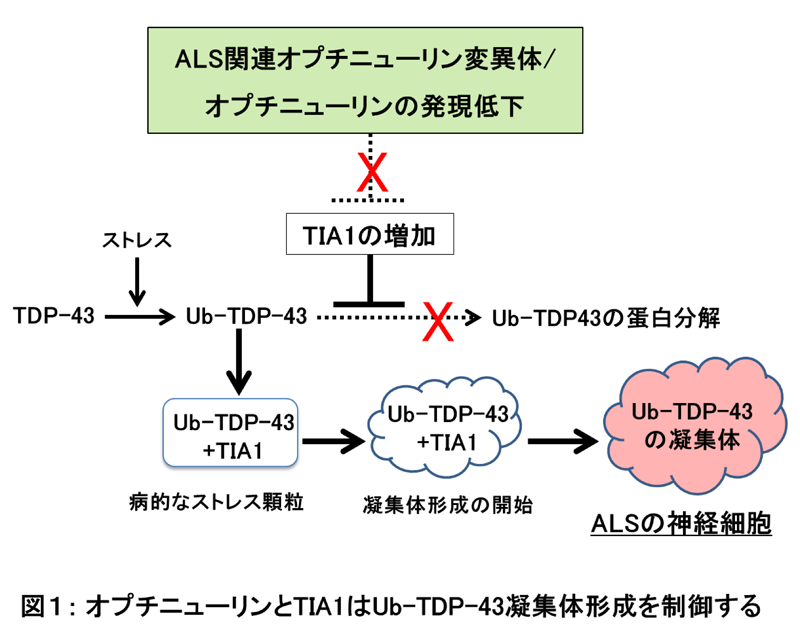
当研究グループは、ALSの病的なUb-TDP-43蛋白質凝集体の形成を、オプチニューリンとTIA1が制御していることを発見しました。家族性ALS由来のオプチニューリン変異体を発現させた細胞を熱ストレスにさらすと、TIA1蛋白質の発現量が増加し、このTIA1がUb-TDP-43蛋白質の分解を阻害し、Ub-TDP-43凝集体の形成を誘導しました(図1)。同様に、正常なオプチニューリンの発現量が減少した細胞では、TIA1の発現量が増加し、Ub-TDP-43蛋白質の分解が阻害され、Ub-TDP-43蛋白質の凝集体が形成されました。従って、正常なオプチニューリンとは対照的に、ALS関連のオプチニューリン変異体ではTIA1の発現が抑制されず、その結果、Ub-TDP-43蛋白質の量が増加し、Ub-TDP-43の凝集体が誘導されることが明らかになりました。家族性ALSのオプチニューリン変異体を発現させた細胞では、Ub-TDP-43がTIA1とともにストレス顆粒に局在していました。ストレス顆粒は、ストレスによって誘導される蛋白質の凝集体です。これまでの多くの研究で、ストレス顆粒に局在したTDP-43が病的なTDP-43凝集体を形成することが示唆されています。当研究グループの結果は、TIA1がUb-TDP-43をストレス顆粒に局在させ、Ub-TDP-43の分解を阻害していることを示唆しています。これらの結果から、正常なオプチニューリンは、Ub-TDP-43凝集体の分解を誘導し、異常な凝集体の形成を抑制するが、ALS患者由来のオプチニューリン変異体は、TIA1の発現を誘導し、Ub-TDP-43凝集体の形成を促進することが示されました。
Ⅲ.研究の成果
ALSで、Ub-TDP-43の凝集体がどのように形成されるのかは不明でした。本研究では、正常なオプチニューリンがUb-TDP-43凝集体の形成を阻害するのに対し、家族性ALS由来のオプチニューリン変異体は、Ub-TDP-43凝集体の形成を促進することを明らかにしました。さらに、TIA1の発現増加が病的なUb-TDP-43蛋白質凝集体の形成を促進することも判明しました。これらの結果は、オプチニューリンとTIA1がALSの治療標的として有望であることを示しています。
Ⅳ.今後の展開
家族性ALSの発症には、TDP-43、オプチニューリン、TIA1に加えて、いくつかの原因遺伝子(TBK1,C9ORF72、p62/SQSTM1など)が関与しており、これらの脳病変でも、Ub-TDP-43凝集体が形成されています。今後は、TDP-43、オプチニューリン、TIA1の変異を持たないALS患者において、オプチニューリンとTIA1がUb-TDP-43凝集体の形成にどのように関与しているかを解析する予定です。さらに、今回の研究により、オプチニューリンとTIA1がALS治療薬の有望なターゲット分子であることがわかりました。今後は、オプチニューリンとTIA1を標的としたALS治療薬の開発を進めていく予定です。
Ⅴ.研究成果の公表
これらの研究成果は、2021年6月17日(米国東海岸時間)、iScience誌(Cell Pressが出版する学際的なオープンアクセスジャーナル、インパクトファクター:4.447)のオンライン速報版に掲載されました。
論文タイトル:The optineurin/TIA1 pathway inhibits aberrant stress granule formation and reduces ubiquitinated TDP-43
著者:Taichi Kakihana, Masahiko Takahashi, Yoshinori Katsuragi, Shun-ichi Yamashita, Junya Sango, Tomotake Kanki, Osamu Onodera, and Masahiro Fujii
doi: 10.1016/j.isci.2021.102733
用語説明
注1:ユビキチン化
ユビキチンは76アミノ酸から成る蛋白質です。ユビキチンは酵素によって蛋白質に付加され、付加された蛋白質の蛋白分解や機能を調節します。
注2:TDP-43
TDP-43遺伝子は家族性ALSの原因遺伝子の1つです。
注3:ユビキチン化TDP-43(Ub-TDP-43)
ユビキチン鎖がTDP-43蛋白質に共有結合している状態を表します。ALS患者の神経細胞では、Ub-TDP-43が蛋白質凝集体を形成し、病気の原因になると考えられています。
注4:オプチニューリン
オプチニューリン遺伝子はALSの原因遺伝子の一つです。オプチニューリン蛋白質は、転写因子NF-κBを介して遺伝子発現を抑制することが知られています。オプチニューリンは炎症応答やオートファジーを調整することが知られています。
注5:TIA1
TIA1遺伝子は家族性ALSの原因遺伝子の1つです。TIA1蛋白質はRNA結合活性を持ち、ストレス顆粒に局在します。TIA1はプリオン様の構造を持ち、蛋白質の凝集体形成を促進します。
注6:ストレス顆粒
ストレス顆粒は、様々なストレスによって細胞質内に誘導される蛋白質の集合体です。ストレス顆粒には、TDP-43やTIA1などのRNA結合蛋白質が数多く含まれています。ストレスが減衰すると、正常なストレス顆粒はオートファジーなどの蛋白質分解機構によって消失します。一方で、病的なストレス顆粒は消失せず、病的なTDP-43凝集体の形成を開始することが示唆されています。
注7:孤発性ALS
家族性(遺伝性)ではない、原因不明のALS。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科ウイルス学分野
教授 藤井 雅寛(ふじい まさひろ)
E-mail:fujiimas@med.niigata-u.ac.jp