ライソシンEは抗結核薬の有望なリード化合物である − 新規の抗菌メカニズムを持った抗菌薬 −
新潟大学大学院医歯学総合研究科細菌学分野のGeberemichal Geberetsadik特任助教、西山晃史講師、松本壮吉教授らの研究グループは、帝京大学(医真菌研究センター・浜本洋准教授、薬学部寄付講座カイコ創薬学講座・関水和久特任教授ら)、大阪健康安全基盤研究所、同研究科顕微解剖学分野との共同研究で、放線菌が産生する抗菌物質ライソシンE(lysocin E)*1が、従来の抗結核薬とは異なる抗菌メカニズムで、多剤耐性結核菌に高い抗菌活性を示すことを明らかにしました。
【本研究成果のポイント】
・結核は現在でも、単独の病原細菌による感染症で最も人命を奪っている。2020年の死亡者数は、150万人に上った(WHO, 2021)。
・新規結核患者及び再燃例全体の治療成功率は85%(2018年)だか、多剤耐性/リファンピシン耐性結核*2では59%(2018年)に低下する(WHO, 2021)。既存の抗結核薬と交差耐性の無い新薬の開発が必要である。
・ライソシンEは放線菌が産生する抗菌物質で、黄色ブドウ球菌等の細胞膜中の電子伝達系のメナキノン*3に結合し、細胞膜を障害して殺菌作用を示すことが報告された。
・本研究グループでは、ライソシンEが多剤耐性菌を含めた結核菌に良好な抗菌活性を示すことを明らかにした。しかも、ライソシンEは除菌に難渋する休眠菌に対しても効果的であった。
・ライソシンEは宿主細胞への浸透性に問題があるものの、同様に浸透性の低い既存薬ストレプトマイシンと比較しても良好な結果を得た。今後の抗結核薬開発において、既存の抗結核薬と交差耐性が無い、新規のメカニズムを持つ有望なリード化合物*4として期待できる。
Ⅰ.研究の背景
結核菌の感染によって引き起こされる結核は、単独の細菌による感染症で最も人命を奪っている。2020 年には HIV/AIDS患者を含め150 万人以上が結核で死亡したと推計される(WHO, 2021)。抗結核薬や環境ストレス等に低感受性となる休眠菌は活動性結核の主要なソースである無症候の潜伏感染や、治療の長期化に深く関連している。また、多剤耐性結核は治療の成功率を低下させる。休眠菌や薬剤耐性菌の除菌に有効な、新しい作用機序を備えた抗結核薬の開発は急務である。
ライソシンEは土壌放線菌(Lysobacter sp. RH2180-5)が産生する抗菌物質である。黄色ブドウ球菌等の細胞膜中のメナキノンに結合し、細胞膜を障害して殺菌作用を示すことが報告された。メナキノンを含む呼吸鎖は、増殖中、休眠中ともに結核菌の生育に必須である。
Ⅱ.研究の概要
本研究は、ライソシンEの結核菌に対する抗菌活性を評価し、その作用機序を解明することを目的とした。ライソシンEを用いて、複数の多剤耐性菌を含む結核菌の薬剤感受性試験を実施し、被検菌に対する最小発育阻止濃度(MIC値)*5、および最小殺菌濃度(MBC値)*6を測定した。結核菌におけるライソシンEの作用機序を明らかにするため、結核菌のメナキノン生合成系の必須遺伝子menA*7の発現抑制株を構築し、結核菌のメナキノン量の低下がライソシンEに対する感受性に及ぼす影響を調べた。また、ライソシンEによる結核菌の細胞膜破壊、呼吸鎖阻害(酸素消費と ATP合成への影響)を評価した。さらに、マクロファージおよびマウス感染モデルでのライソシンEの有効性を評価した。
Ⅲ.研究の成果
ライソシンEは、薬剤感受性試験において、薬剤感受性および耐性結核菌に対して高い抗菌作用を示した。薬剤耐性菌を含めた結核菌に対するライソシンEのMIC値は≤0.5 μg/mlであった。また、結核菌H37Rv株に対するMBC値は0.5 μg/mlで、高い殺菌作用を示した。特に、ライソシンEは7日間で結核菌の生菌数を1/104に低下させ、比較した既存の一次除菌薬(イソニアジド、リファンピシン、エタンブトール)よりも優れた除菌効果を示した(図1A)。ライソシンEの抗菌活性は試験培地中に添加したメナキノンによって中和された。また、結核菌のメナキノンの含有量を有意に低下させたmenA発現抑制株は、ライソシンに対する感受性が低下したことから、結核菌でもライソシンEが細胞膜のメナキノンに結合して抗菌作用を発現していることが示唆された(図1B)。実際に、電子顕微鏡解析等によって、ライソシンEが結核菌の細胞膜を障害することを明らかにした(図1B)。また、ライソシンEは、ATP合成酵素を標的とする既存薬ベダキリンよりも顕著に結核菌の酸素消費とATP合成を阻害した。このように、ライソシンEは、細胞膜障害と呼吸阻害の相乗効果によって、結核菌に対して高い抗菌活性を発現すると考えられた。さらに、ライソシンEは休眠抗酸菌に対しても効果を示した。
THP1細胞株から分化させたマクロファージに感染した結核菌に対するライソシンEの抗菌活性は、培地中の結核菌に対する活性よりも低かった。これは、ライソシンEのマクロファージ内への浸透性が低いことが原因である可能性がある。しかし、ライソシンEの感染結核菌への有効性は、同じく細胞内浸透性の低い一次除菌薬ストレプトマイシンよりも優れており、またマクロファージ及びマウス感染モデルで結核菌の生菌数を減少させていることから、今後の新薬開発の有望なリード化合物であると言える。
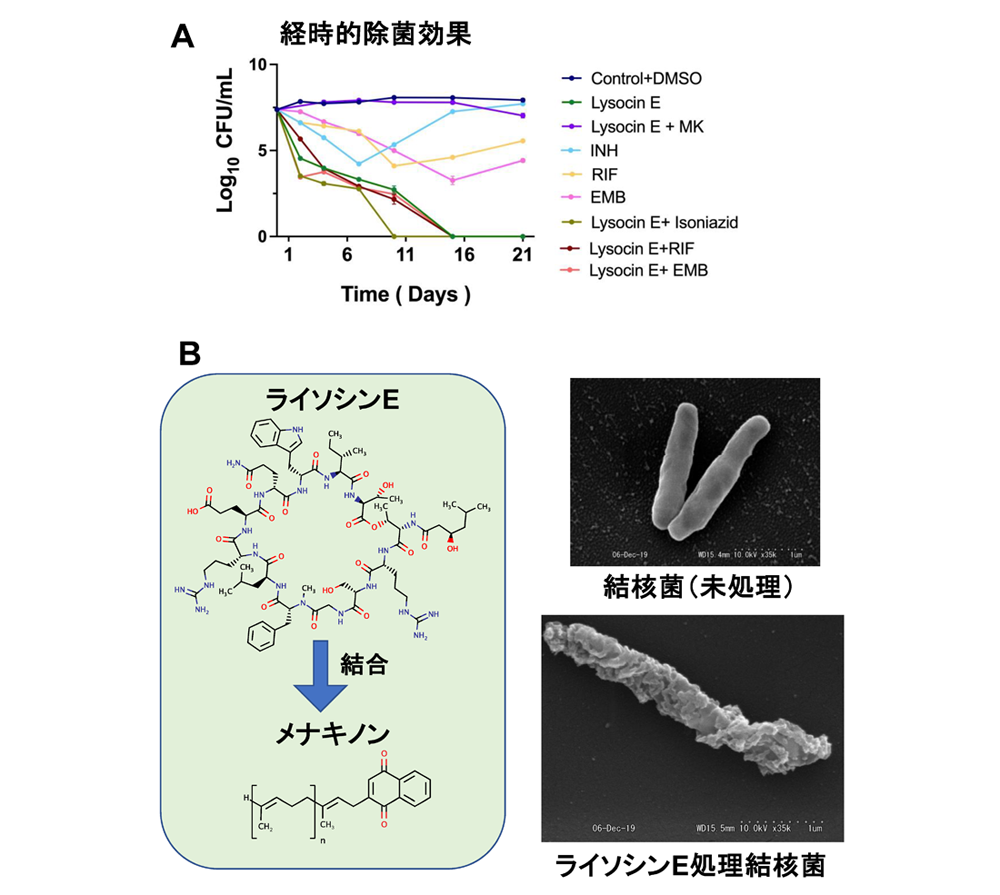
図1. 結核菌に対するライソシンEの抗菌効果. A. 既存の一次除菌薬(イソニアジド[INH]、リファンピシン[RIF]、エタンブトール[EMB])と比較して、ライソシンEは培養液中の結核菌を迅速に除菌した。Lysocin E, ライソシンE。MK, メナキノン。INH, イソニアジド。RIF, リファンピシン。EMB, エタンブトール。CFU/ml, 生菌数。B. ライソシンEは結核菌細胞膜のメナキノンに結合し、最終的に結核菌の細胞膜を破壊する。
Ⅳ.今後の展開
本研究成果によりライソシンEが、既存の抗結核薬とは異なる抗菌メカニズムを持ち、従来の多剤耐性菌等を含む薬剤耐性結核菌や、現在の活動性結核の主要なソースであり、治療の長期化の主要因でもある休眠菌にも有効な、有望な抗結核薬候補であることが示された。今後は、ライソシンEをベースに、細胞内および生体内での除菌効果の改善など、臨床での使用を目指して開発を進めていく予定である。
Ⅴ.研究成果の公表
本研究成果は、2022年9月20日、米国微生物学会(American Society for Microbiology)のAntimicrobial Agents and Chemotherapy誌に掲載された。
論文タイトル:Lysocin E Targeting Menaquinone in the Membrane of Mycobacterium tuberculosis Is a Promising Lead Compound for Antituberculosis Drugs
著者:Geberemichal Geberetsadik, Akane Inaizumi, Akihito Nishiyama, Takehiro Yamaguchi, Hiroshi Hamamoto, Suresh Panthee, Aki Tamaru, Manabu Hayatsu, Yusuke Mizutani, Shaban Amina Kaboso, Mariko Hakamata, Aleksandr Ilinov, Yuriko Ozeki, Yoshitaka Tateishi, Kazuhisa Sekimizu, Sohkichi Matsumoto
Antimicrobial Agents and Chemotherapy. 2022 Sep 20, VOLUME 66, ISSUE 9, e0017122.
doi: 10.1128/aac.00171-22.
【用語解説】
*1 ライソシンE(lysocin E):土壌放線菌Lysobacter sp. RH2180-5株の培養上清から分離された抗菌物質。黄色ブドウ球菌等の細胞膜中のメナキノンに結合し、細胞膜を障害して殺菌作用を示すことが報告された(Hamamoto H et al. Nat Chem Biol. 2015. 11:127-33)。
*2 多剤耐性/リファンピシン耐性結核:結核治療に重要な一次除菌薬リファンピシン(リファンピシン耐性)、または一次除菌薬イソニアジド、リファンピシンの両方に耐性(多剤耐性)な結核菌によって引き起こされる結核。
*3 メナキノン:一般的にはビタミンK2として知られる。結核菌、黄色ブドウ球菌等では細胞質膜に存在する電子伝達系において電子伝達体として働く。
*4 リード化合物:新薬(今回では新規抗結核薬)の開発のもととなる候補化合物。
*5 最小発育阻止濃度(MIC値):一定濃度の被検菌の増殖を抑制する薬剤の最小濃度。
*6 最小殺菌濃度(MBC値):一定濃度の被検菌を殺菌する薬剤の最小濃度。
*7 menA:メナキノン生合成系の1, 4-dihydroxy-2-naphthoic acid prenyltransferaseをコードする遺伝子。結核菌では必須遺伝子。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科細菌学分野
講師 西山 晃史(にしやま あきひと) E-mail:anishi@med.niigata-u.ac.jp
教授 松本 壮吉(まつもと そうきち) E-mail:sohkichi@med.niigata-u.ac.jp






