新規ミトコンドリア分裂因子を発見 〜マイトファジーの過程におけるミトコンドリア分裂のメカニズムを解明〜
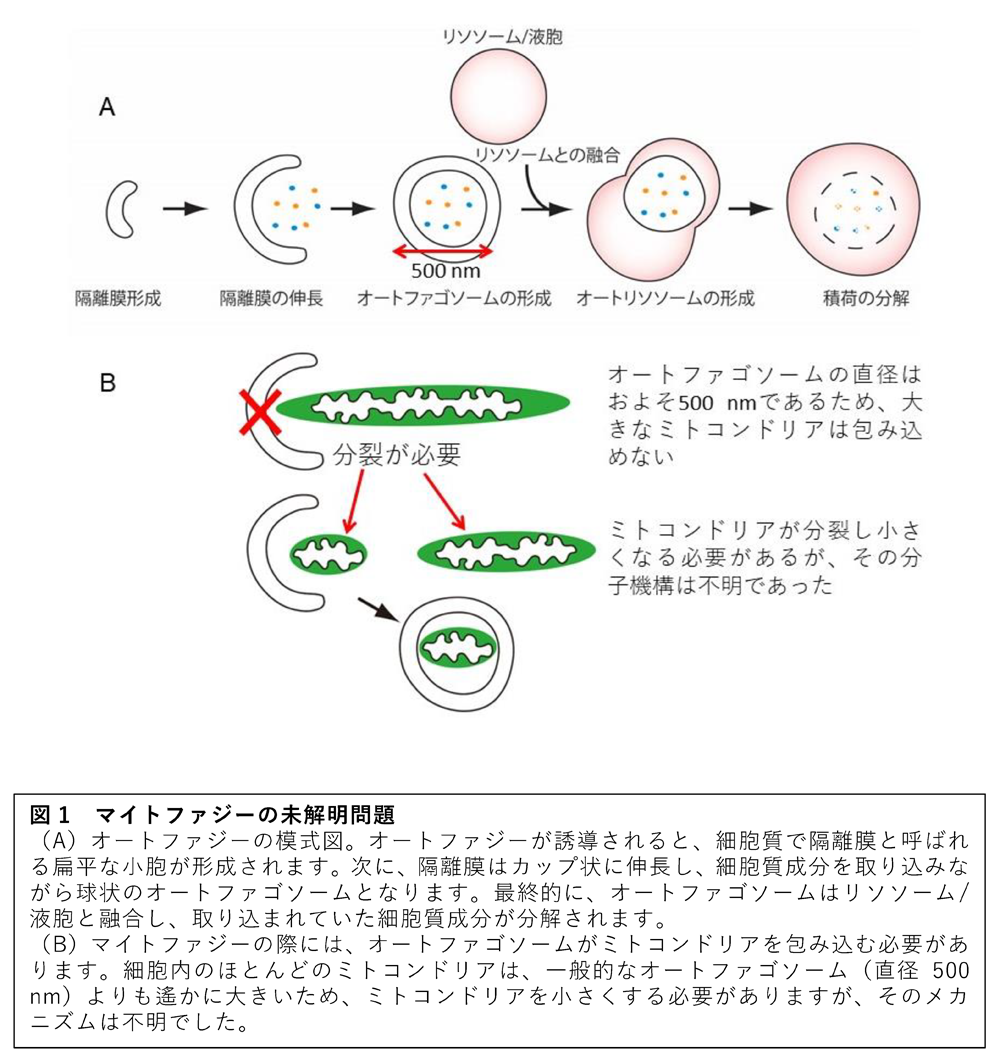
ミトコンドリアオートファジー(マイトファジー)は、オートファジー(1)がミトコンドリアを選択的に分解する現象であり、ミトコンドリアの品質管理に重要な役割を果たします。マイトファジーの過程で、ミトコンドリアはオートファゴソームと呼ばれる球状の脂質膜に包まれます。この際に、大きなミトコンドリアが小さなオートファゴソームに包み込まれるメカニズムは、長らく不明でした。
新潟大学大学院医歯学総合研究科の福田智行准教授、古川健太郎医学部准教授、神吉智丈教授、微生物化学研究所の丸山達朗上級研究員、北海道大学遺伝子病制御研究所の野田展生教授らの研究グループは、新規のミトコンドリア分裂因子であるMitofissin(Mitochondrial fission protein、マイトフィッシン)を発見し、この因子がマイトファジーの際にミトコンドリアをオートファゴソームに収まる大きさに分裂させることを明らかにしました。また、Mitofissinは、ミトコンドリア膜に直接作用して膜を切断することができるため、分裂の機序に関するこれまでの概念を覆す新たなメカニズムで作用することも明らかにしました。本研究は、マイトファジーの分子機構について未解決であった問題を解明しただけではなく、オルガネラ(細胞小器官)の形態変形に関する全く新しいメカニズムの存在を明らかにした点でも、重要な成果です。
本研究は、生命創成探究センター/生理学研究所の村田和義特任教授、理化学研究所生命機能科学研究センターの岡田康志チームリーダー(東京大学大学院医学系研究科教授)、新潟大学の芝田晋介教授、米国ミシガン大学Daniel J. Klionsky教授らとの共同研究で行われました。
【本研究成果のポイント】
・新規ミトコンドリア分裂因子Mitofissin/Atg44を発見
・Mitofissinによるミトコンドリア分裂がマイトファジーに必須であることを解明
・Mitofissinはミトコンドリア膜に直接結合し、膜の脆弱性を生み出すことで膜を切断することを解明
Ⅰ.研究の背景
ミトコンドリアは、細胞が必要とするエネルギーの大半を産生する非常に重要なオルガネラです。細胞内には、大小さまざまなサイズのミトコンドリアが存在し、分裂することで小さくなり、融合することで大きくなります。オートファジーがミトコンドリアを分解するためには、ミトコンドリアがオートファゴソームより小さくなる必要があります(図1)。本研究グループは以前、ミトコンドリア分裂に必須と考えられていたダイナミン様タンパク質(酵母ではDnm1、哺乳類ではDrp1)(2)がマイトファジーには必要ないことを報告しました(Yamashita et al. JCB 2016)。そのため、Dnm1/Drp1以外のミトコンドリア分裂因子がマイトファジーに関与している可能性が示唆されましたが、そのような因子の存在自体も含めて、分裂のメカニズムは全く理解されていませんでした。
Ⅱ.研究の概要
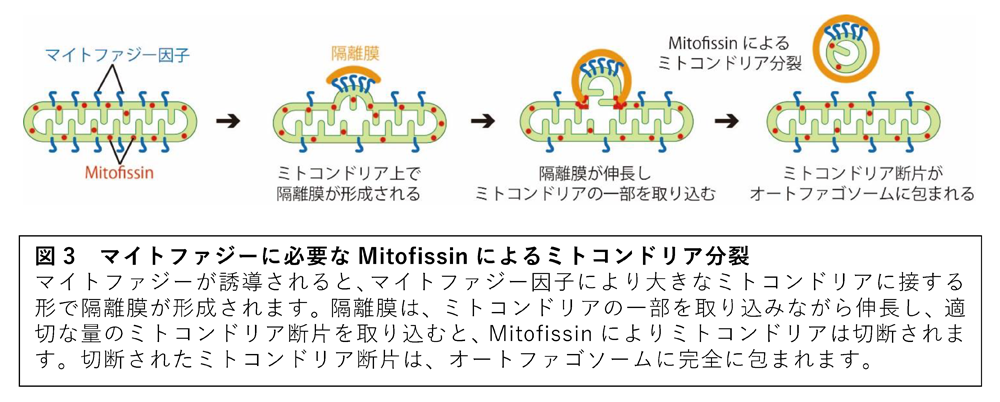
本研究グループは、酵母(3)を用いてマイトファジーに必須の因子を探索し、Atg44タンパク質を同定しました。後述のように、Atg44の主たる機能がミトコンドリア分裂の促進であったことから、この種のタンパク質をMitofissin (Mitochondrial fission protein)と命名しました。Mitofissinは、ミトコンドリア膜間腔に局在し、73のアミノ酸で構成される小さなタンパク質でした。Mitofissinの欠損株は、既知のミトコンドリア分裂因子Dnm1の欠損株と同じような、膨潤した大きなミトコンドリア形態を示すことが分かりました。また、Mitofissinの欠損株では、マイトファジーが誘導されると、ミトコンドリアから隔離膜の形成基点に向けてミトコンドリアの突起が形成され、この突起を隔離膜が包み込もうとしますが、ミトコンドリア分裂が抑制されているため、突起がミトコンドリアの本体とつながった状態でマイトファジーが停止することが明らかになりました。これらの結果から、Mitofissinはミトコンドリア分裂因子であり、Mitofissinが引き起こすミトコンドリア分裂がマイトファジーに必須であると結論付けました。さらに、Mitofissinをヒト培養細胞において発現させると、Drp1とは独立にミトコンドリアが分裂することが観察されたことからも、Mitofissinがミトコンドリア分裂因子であることが裏付けられました。
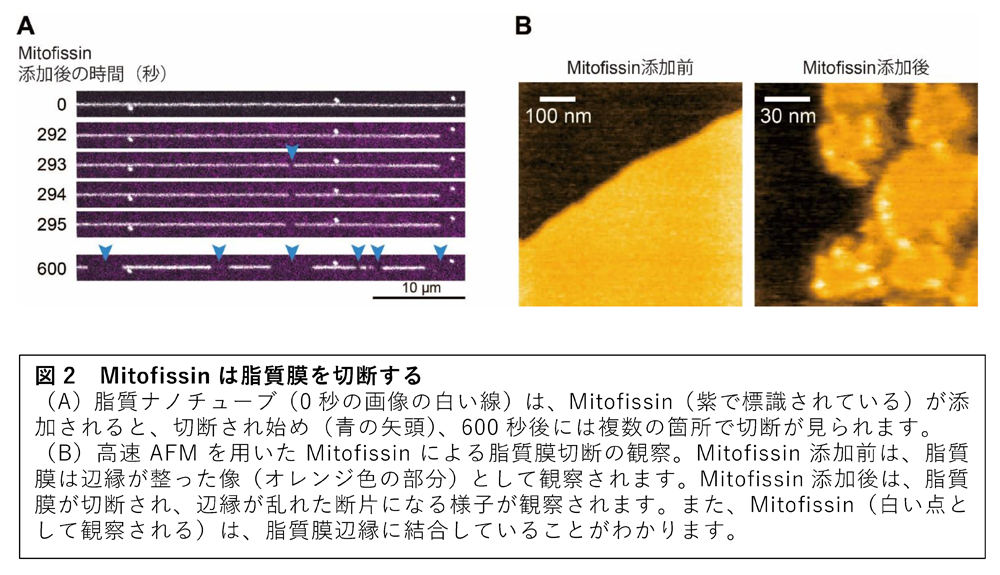
In vitro実験(4)において、精製したMitofissinを脂質ナノチューブに添加すると、脂質ナノチューブの切断が観察されました(図2A)。また、マイカ基板上に脂質膜を用意し、Mitofissinを添加した後に高速AFM(5)で観察すると、Mitofissinが脂質膜辺縁に集積し、その部位の脂質膜が切断される様子が観察されました(図2B)。Mitofissinの結晶構造解析(6)から、Mitofissinは疎水性面と親水性面を持つ両親媒性構造を有しており、疎水性面が脂質膜に結合することがシミュレーション解析により示唆されました。以上から、Mitofissinは脂質膜に直接結合し、脂質膜の脆弱性を産み出すことで膜を切断すると考えられます。
Ⅲ.研究の成果
本研究グループは、新規のミトコンドリア分裂因子であるMitofissinを同定し、その機能解析と構造解析から、従来知られていたダイナミン様タンパク質によるミトコンドリア分裂とは異なる作用機序でミトコンドリアを分裂させていることを発見しました。また、Mitofissinは、マイトファジーの際にミトコンドリアをオートファゴソームに収まる大きさにするために必須であることも明らかにし、マイトファジーの分子機構に関する最大の謎を解明することができました(図3)。ミトコンドリアの形態変化とマイトファジーは、互いに協調して機能することでミトコンドリアの品質を維持しています。そのため、マイトファジーに必須のミトコンドリア分裂因子Mitofissinの発見と解析は、ミトコンドリアの機能低下を伴う疾患の治療法開発につながると期待されます。
Ⅳ.今後の展開
ミトコンドリアの形態は、ミトコンドリアの機能に大きく影響することが知られています。Mitofissinを利用して、人工的にミトコンドリアの形態を調整することで、疾患や傷害によって損なわれたミトコンドリアの機能を改善することを目指しています。また、Mitofissinと同じように、脂質膜に直接作用することで、オルガネラのような膜で構成される構造体の形態や機能を制御する分子の探索も進めています。
Ⅴ.研究成果の公表
これらの研究成果は、2023年5月15日午前11時(米国東部時間)、科学誌「Molecular Cell」(IMPACT FACTOR 19.328)のオンライン版に掲載されました。
論文タイトル:The mitochondrial intermembrane space protein mitofissin drives mitochondrial fission required for mitophagy(ミトコンドリア膜間腔に局在するMitofissinがマイトファジーに必要なミトコンドリア分裂を駆動する)
著者:Tomoyuki Fukuda#, Kentaro Furukawa#, Tatsuro Maruyama#, Shun-Ichi Yamashita, Daisuke Noshiro, Chihong Song, Yuta Ogasawara, Kentaro Okuyama, Jahangir Md. Alam, Manabu Hayatsu, Tetsu Saigusa, Keiichi Inoue, Kazuho Ikeda, Akira Takai, Lin Chen, Vikramjit Lahiri, Yasushi Okada, Shinsuke Shibata, Kazuyoshi Murata, Daniel J. Klionsky, Nobuo N. Noda*, Tomotake Kanki*(福田智行#、古川健太郎#、丸山達朗#、山下俊一、能代大輔、Chihong Song、小笠原裕太、奥山健太郎、Jahangir Md. Alam、早津学、三枝徹、井上敬一、池田一穂、高井啓、Lin Chen、Vikramjit Lahiri、岡田康志、芝田晋介、村田和義、Daniel J. Klionsky、野田展生*、神吉智丈*)#同等貢献、*責任著者
Doi:10.1016/j.molcel.2023.04.022
Ⅵ.本研究への支援
本研究は、JSPS科研費22H02615、19H05712、18H04858、18H04691、17H03671、15KK0253、21K05500、23H04255、20K06552、19H05707、16H06280、19H05794、22H04926、AMED JP21gm6110013、JP22bm0704046、JST JPMJCR20E3、JPMJMS2025-14、JPMJCR20E2 、JPMJCR20E5、武田科学振興財団、野田産研研究助成、NIH GM131919の支援を受けて行われました。
●用語の説明
(1)オートファジー:細胞内で新たに作り出された脂質の膜(隔離膜)が伸長し、細胞成分を包み込むように球状の構造(オートファゴソーム)が形成されます。膜に包まれた成分は分解酵素によって低分子へと分解されます。この一連の反応をオートファジーと呼びます。オートファジーはタンパク質をアミノ酸に分解して栄養として再利用するだけでなく、ミトコンドリアや小胞体のような細胞小器官を分解することで、その質や量を調節しています。細胞小器官のような比較的大きな細胞成分を包み込んで分解するためには、各細胞成分に特異的なメカニズムが必要です。
(2)ダイナミン様タンパク質Dnm1/Drp1:ミトコンドリアの分裂に必須なタンパク質で、分裂時にミトコンドリアの外側にリング状に集まり、リングが収縮することでミトコンドリアを分裂させます。Dnm1/Drp1 を欠損した細胞では、ミトコンドリアの分裂ができなくなり、長くつながった大きなミトコンドリアが細胞内に見られるようになりますが、マイトファジーは正常に起こります。
(3)酵母:分裂により増殖する分裂酵母、出芽により増殖する出芽酵母などがあります。両者とも単細胞生物ですが、細胞内の基本的な現象には高等生物と共通点が多く見られ、遺伝子操作が簡便に行えることから、モデル生物として利用されています。オートファジーに関与する因子の多くは酵母で最初に発見されています。
(4)In vitro実験:生き物の体内や細胞内の環境を試験管内で人工的に作り上げ、タンパク質や遺伝子の働きなどを解析する実験を意味します。
(5)高速AFM:高速原子間力顕微鏡(High-Speed Atomic Force Microscope)の略。試料の表面を探針でなぞることで表面の凹凸情報を計測し、画像化する顕微鏡。タンパク質のような小さな分子でも観察できます。また、高速で画像を取得できるため、生体分子の反応や構造変化をリアルタイムで観察できます。
(6)結晶構造解析:三次元的に規則正しく並んだ結晶はX線を回折する性質があり、この性質を利用して結晶を構成する原子が立体的にどのように配置されているのかを決定する手法です。タンパク質の立体構造を明らかにするために広く利用されています。
本件に関するお問い合わせ先
【研究に関すること】
新潟大学大学院医歯学総合研究科・機能制御学分野
教授 神吉 智丈(かんき ともたけ)
E-mail:kanki@med.niigata-u.ac.jp
微生物化学研究所 構造生物学研究部
上級研究員 丸山 達朗(まるやま たつろう)
E-mail:maruyamat@bikaken.or.jp
北海道大学遺伝子病制御研究所・生命分子機構分野
教授 野田 展生(のだ のぶお)
E-mail:nn@igm.hokudai.ac.jp
自然科学研究機構生命創成探究センター 物質-生命境界領域研究グループ/
生理学研究所 生体分子構造研究部門
特任教授 村田 和義(むらた かずよし)
E-mail:kazum@nips.ac.jp
理化学研究所 生命機能科学研究センター 細胞極性統御研究チーム
チームリーダー 岡田 康志(おかだ やすし)
(東京大学大学院医学系研究科 細胞生物学分野 教授)
E-mail:y.okada@riken.jp
【広報担当】
新潟大学広報事務室
E-mail:pr-office@adm.niigata-u.ac.jp
微生物化学研究所 知的財産情報部
E-mail:chizaijoho@bikaken.or.jp
北海道大学社会共創部広報課
E-mail:jp-press@general.hokudai.ac.jp
生命創成探究センター 研究戦略室
E-mail: press@excells.orion.ac.jp
生理学研究所 研究力強化戦略室
E-mail: pub-adm@nips.ac.jp
理化学研究所 広報室 報道担当
E-mail:ex-press@ml.riken.jp