伸びる神経突起先端の動きを超高解像で可視化に成功 −ミクロ世界の自動走行を担う分子機構を解明−
脳ができるとき、または損傷後に神経が再生するときには、神経突起の先端に形成される「成長円錐」が自律的に突起を正しいルートに先導することで正常な神経回路が作られます。本学大学院医歯学総合研究科の五十嵐道弘教授、野住素広講師らの研究グループは、超高解像顕微鏡を使って、神経の先端が伸びるとき、同時に先端から細胞膜を取り込む仕組みを明らかにしました。神経成長に不可欠なこの過程は、神経細胞が細胞体から遠く離れた先端から効率的に情報を取り込むのに利用していると考えられます。
本研究成果は、本学大学院医歯学総合研究科と産業技術総合研究所の共同研究によるもので、Cell Reports(オープンアクセスの電子ジャーナル:インパクトファクター 7.870)に平成29年3月1日(水)午前2時(日本時間)に掲載されました。
【本研究成果のポイント】
・神経先端(成長円錐)のこれまで見え難かった細胞内微細構造(アクチン細胞骨格、細胞膜、細胞膜に含まれるタンパク質など)を、超解像顕微鏡を使って鮮明に撮影することに成功した。
・アクチン細胞骨格の伸長とアクチン束形成で神経突起が伸びるとき、同時にその近傍で細胞膜が取り込まれて、輸送小胞が生じることを発見した。それらに関係する分子を明らかにした。
・神経先端(成長円錐)における細胞膜取り込みは神経成長に必要であることから、神経が伸びる際の先端からの情報伝達に関係すると考えられる。
Ⅰ.研究の背景
成長円錐は伸長中の神経突起の先端に生じる構造で、細胞外の誘導因子に反応して神経突起を正しい方向へ先導することが知られています。環境に応じて正しい経路を自走する成長円錐は、体内におけるミクロの自動運転車と考えることもできます。脳の発生や神経損傷後の再生に不可欠な成長円錐ですが、1つの分子集合体としてどのように"自動走行"を実現させているかはまだ完全に説明できていません。神経成長を傘が開くことに例えると、傘の骨(細胞骨格)と傘の布(膜)とが、どのように同調して動いていくのか、これまでは全く解りませんでした。
Ⅱ.研究の概要
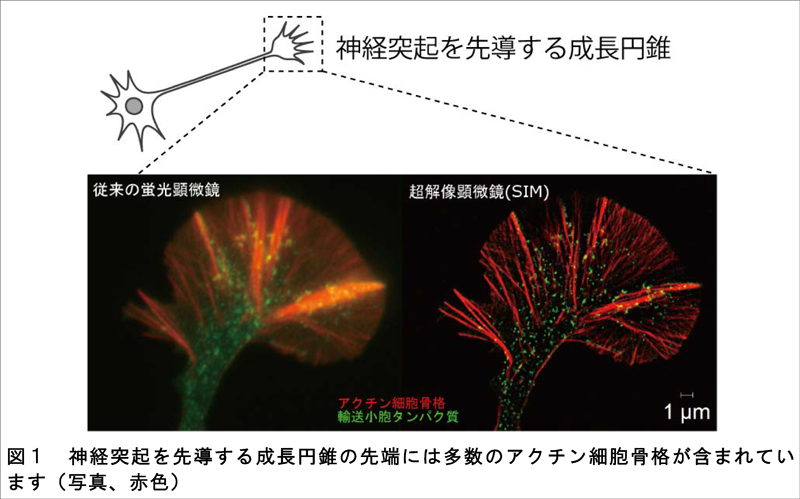
成長円錐が動く仕組みを明らかにするため、私たちの研究グループはこれまでにプロテオミクス解析を行い、成長円錐を構成する部品であるタンパク質を網羅的に同定しました(Nozumiら, 2009)。次にそれらのタンパク質が成長円錐のどこに存在するかを明らかにするため、蛍光タンパク質とつないで細胞に発現させて、蛍光顕微鏡で生きた成長円錐で観察を行いました。その観察を通じて、成長円錐の先端から細胞膜が頻繁に細胞内に取り込まれていることが分かりました。成長円錐の中でも先端部分はアクチン細胞骨格が沢山存在し、骨格の伸長により実質的な神経の伸びを生み出す重要な領域です(図1)。
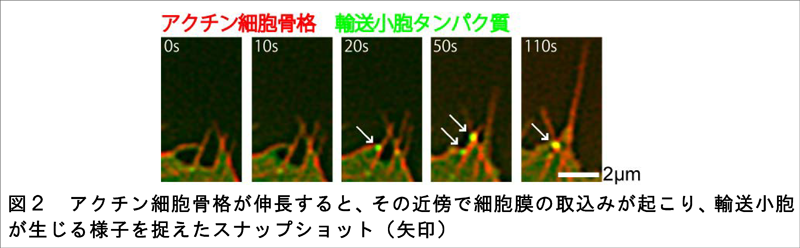
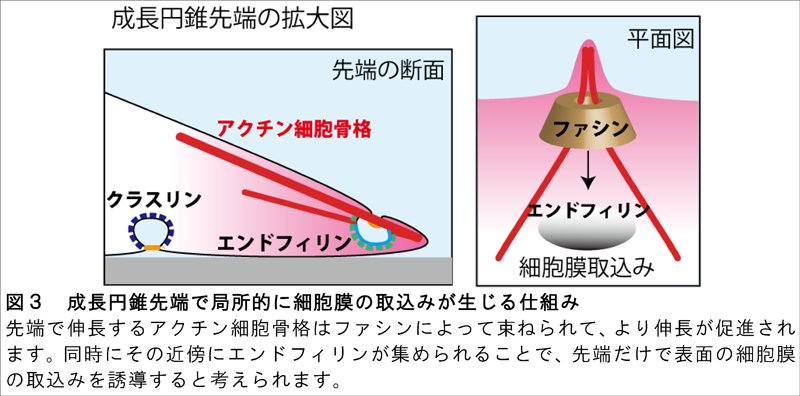
成長円錐の先端部分におけるアクチン細胞骨格と細胞膜のそれぞれの動きを詳細に観察するため、従来の顕微鏡より分解能が格段に優れている超解像顕微鏡(SIM)を使って撮影を行いました。その結果、アクチン細胞骨格が伸長し、アクチンの束を形成するとき、同時にその近傍で細胞膜の一部が細胞内に取り込まれて輸送小胞が生まれる様子を動画で初めて捉えることに成功しました(図2)。この細胞膜の取込みは、エンドフィリンと呼ばれるタンパク質が集まって引き起こされることが分かりました。アクチンの束形成を人為的に阻害したところ、成長円錐のアクチン束が減るだけに留まらず、成長円錐の先端にエンドフィリンが集まらなくなりました。これらの結果から、神経先端ではアクチン細胞骨格の伸長によって局所的な細胞膜取込みが誘導されていると結論しました。阻害実験を行い、神経成長にエンドフィリンが必要であることも証明しました。超解像顕微鏡による成長円錐構造の3次元再構成の結果、細胞膜取込みの誘因因子として広く知られているクラスリンは成長円錐の底面膜に多いのに対し、エンドフィリンは成長円錐表面の細胞膜に多く集積することが初めて明らかになりました(図3)。これらの結果から、神経が伸びながら先端表面の細胞膜を積極的に取り込むことによって、細胞外環境を探る成長円錐のメカニカルな仕組みが解明できました。
Ⅲ.研究の成果
これまで知られていなかった神経先端での細胞骨格と細胞膜取込みの関係を明らかにしました。アクチン細胞骨格が伸長することにより、近傍で細胞膜の取込みが生じ、作られた輸送小胞はアクチン細胞骨格と一緒に細胞内へと取り込まれます。これは成長円錐が前進しつつ、進行方向から物質を取り込むのに非常に便利な仕組みであると考えられます。
取り込まれる細胞膜にはコレステロールが含まれていることが明らかになりました。コレステロールは細胞膜の一部で脂質ラフトと呼ばれる微小領域を形成し、細胞外から細胞内への分子シグナルを効率的に伝達していると考えられています。今回の観察では、脂質ラフトに集積する膜タンパク質も神経先端から細胞膜と一緒に取り込まれることが分かりました。成長円錐が先端で細胞外の分子を捕らえ細胞内に取り込んで、情報伝達を行うための仕組みと考えることができます。
神経突起の先端に生じる成長円錐は非常に小さく、厚みの薄い構造なので、従来の顕微鏡では平面的にしか見えていませんでした。今回の超解像顕微鏡による解析では、約1マイクロメートル(1ミリメートルの1000分の1)の厚みをもつ成長円錐を3次元的にスライスして再構成することに成功しました。この可視化技術は、これまで観察が難しかった生体試料の微小立体構造の解明に効果的だと考えられます。
Ⅳ.今後の展開
今回発見した神経先端からの細胞膜取込みは、成長円錐の機能に重要な役割を果たしている可能性が極めて高いと考えられます。アクチン細胞骨格と協調して生じる細胞膜の取込みと神経成長を促進するシグナル伝達の関係を明らかにすることは、成長円錐が持っている"自動走行"機能の分子機構の解明につながります。また神経成長の分子基盤解明は、損傷神経回路の再生・再建および老化や疾患に対する神経再活性化の方法開発にも大きく寄与することが期待されます。これまで骨格と膜の協調運動がわからず、どのように神経を再生できるかわからなかったものが、今回の研究で解明でき、神経再生への基盤が解明できたと思います。
Ⅴ.研究成果の公表
これらの研究成果は、本学大学院医歯学総合研究科と産業技術総合研究所の加藤薫博士との共同研究で得られたもので、平成29年2月28日のCell Reports誌(IMPACT FACTOR 7.870, 5 YEAR IMPACT FACTOR 8.122)に掲載されました。
論文タイトル:Coordinated Movement of Vesicles and Actin Bundles during Nerve Growth Revealed by Superresolution Microscopy
著者:Motohiro Nozumi¹, Fubito Nakatsu¹,³, Kaoru Katoh⁴, Michihiro Igarashi¹,²
1) Department of Neurochemistry and Molecular Cell Biology, Graduate School of Medical and Dental Sciences
2) Trans-disciplinary Research Program, Niigata University, Chuo-ku, Niigata 951-8510, Japan
3) PRIME, Japan Agency for Medical Research and Development (AMED), Chiyoda-ku, Tokyo 100-0004, Japan
4) Biomedical Research Institute, National Institute of Advanced Industrial Science and Technology (AIST), Tsukuba, Ibaraki 305-8566, Japan
野住素広¹、中津史¹,³、加藤薫⁴、五十嵐道弘¹,²
1) 新潟大学大学院医歯学総合研究科神経生化学・分子細胞生物学
2) 新潟大学超域学術院
3) AMED-PRIME
4) 産業技術総合研究所バイオメディカル研究部門
doi: http://dx.doi.org/10.1016/j.celrep.2017.02.008
<用語集および補足説明>
1)成長円錐
神経突起が伸びるとき、その先端にアメーバ状の運動性の高い構造体が作られます。これを成長円錐(growth cone)と呼びます。成長円錐は貨物列車の機関車のように目的地まで神経突起を牽引すると、標的の細胞に対してシナプスを形成します。私たちの神経細胞の中には1mもの神経突起を伸ばすものも存在し、その成長円錐は自分のサイズの約10万倍の距離を移動することになります。移動ルートは線路のように予めガイド分子(ガイダンス分子)が敷かれている場合もあれば、目的地の細胞や中継地点の細胞からガイダンス分子が放出されることもあります。ガイダンス分子には成長円錐に対して「こっちに来い」の意味をもつ誘因性ものと、逆に「こっちに来るな」という反発性のものがあり、成長円錐はそれぞれのガイダンス分子を受け取りながら正しいルートを選択します。
成長円錐の細胞膜上にはガイダンス分子を受け取るための様々な受容体が存在しています。成長円錐内では受け取ったガイダンス分子に応じて、アクチンなどの細胞骨格を組み立てたり、壊したりすることで、成長円錐の形が変化します。細胞骨格の調節と同時に足場となる接着分子や細胞膜も総合的に変化することで、成長円錐の進行方向、前進または停止を制御していると考えられています。
2)超解像顕微鏡
光学顕微鏡は光源に可視光線(波長が約400〜750nm)を用いるため、原理的に200nmの分解能が限界だと考えられてきました。そのため、医学生物学分野では極めて微細な生体構造・分子を見るために、可視光よりも波長が短い電子線を光源とする電子顕微鏡を用いています。しかし、生きた生体試料を観察したり、同時に多種類の分子を可視化するには光学顕微鏡を使うしかありません。最近、光学限界の壁を破る複数の方法が開発されて、100〜20nmの分解能をもつ「超解像顕微鏡」が使えるようになりました。2014年には超解像顕微鏡の開発者3名にノーベル化学賞が贈られるほど、サイエンスの発展に大きな影響を及ぼしています。
本研究で用いたのはその1つである構造化照明顕微鏡(SIM)です。縞模様の照明を用いることで、得られる蛍光像に干渉縞が含まれます。その干渉縞には試料の微細構造の情報が含まれており、計算によって画像に再現することができます。この方法によって、100nm程度の分解能を持つ生体画像が得られます。SIMは生きた細胞が観察可能で、他の超解像顕微鏡に比べて様々な蛍光分子がそのまま使えるのが大きな利点です。
3)エンドフィリン
エンドフィリンはBARドメインという特別な構造を持つタンパク質の1つで、2量体を形成することで弓状の構造をとり、曲率を持つ細胞膜に結合します。クラスリン介在性のエンドサイトーシス(細胞膜の取込み)に関与すると考えられてきましたが、クラスリン以外の分子と協調してエンドサイトーシスを誘導するとの報告もあります。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科
神経生化学分野
五十嵐道弘 教授 e-mail:tarokaja@med.niigata-u.ac.jp
野住素広 講師 e-mail:mnozumi@med.niigata-u.ac.jp