神経細胞での脂質ラフトを介した新たなシグナル伝達制御を発見 −うつ病やアルツハイマー病,BSE,HIV脳症などの研究に貢献−
本学医歯学総合研究科 五十嵐道弘教授、本多敦子特任助教、伊藤泰行助教らの研究グループは、神経細胞表面においてGPM6aタンパク質がトランスデューサー(シグナル変換器)*¹として作用し、細胞外から細胞内へのシグナル伝達*¹を、脂質ラフト*²を介して制御する機構を世界で初めて発見しました。
この発見は、細胞外基質*³のシグナルに応じた神経細胞極性*⁴の決定制御機構を明らかにしただけでなく、うつ病、アルツハイマー病、BSE、HIV脳症などGPM6a発現低下が関係する疾患の研究への貢献が期待されます。本研究成果は、本学大学院医歯学総合研究科と愛知県心身障害者コロニー発達障害研究所、愛知医科大学との共同研究によるもので、The Journal of Neuroscience(インパクトファクター 6.780)に2017年3月8日(水)(米国時間)オンライン速報版に掲載されました。
【本研究成果のポイント】
・神経の脂質ラフトにあるGPM6aタンパク質の局在化が、脂質ラフトと神経極性決定に関与する細胞内シグナル分子の集積を誘導し、脂質ラフトにおけるシグナル伝達を制御することを発見。
・GPM6aタンパク質が、細胞外基質ラミニンの刺激に応じて細胞表面でのシグナル変換器(トランスデューサー)として作用し、ラフトを介してシグナル伝達の増強することで、素早い神経極性決定を誘導することを明らかにした。
・GPM6タンパク質発現の抑制は、脳内での神経発生に重要な神経極性決定を停滞させたことから、GPM6aの発現量の低下が、ストレスやウイルス感染に伴う神経疾患の発症機序に関係していると考えられる。
Ⅰ.研究の背景
脂質ラフト(ラフト)は、主に糖脂質とコレステロールから構成される細胞膜上の微小膜領域で、シグナル分子が集積するシグナル伝達の場として大事な役割を持ちます。またラフトは、疾患や細菌・ウイルス感染などにも深く関係し、様々な細胞においてその重要性が示されていますが、脳の神経細胞ではラフトの具体的な役割は殆ど分かっていません。一方、神経細胞はこれらの脂質が他の細胞に比べて圧倒的に大量に存在するため、ラフトの重要性も非常に高いものと考えられます。
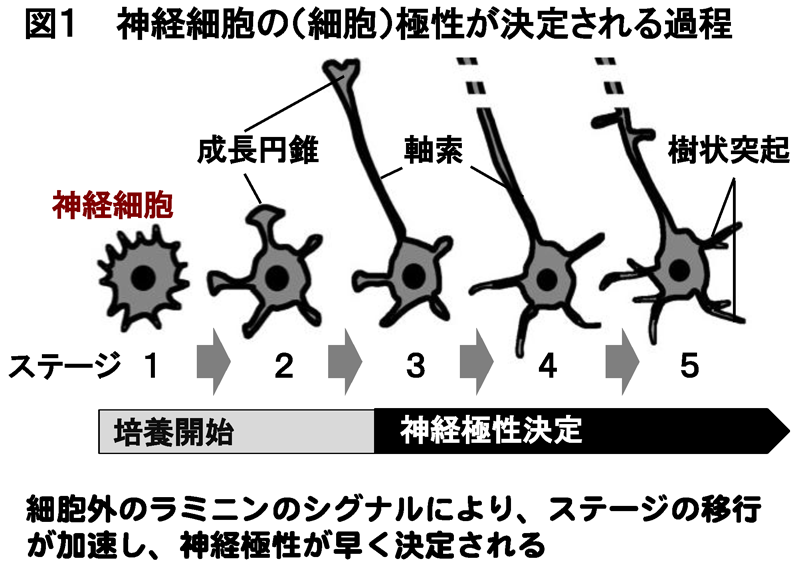
神経細胞は、脳における精密な回路形成や情報の伝達のため、軸索とよばれる一本の長い突起と樹状突起とよばれる短い多数の突起を形成します(図1)。この神経極性決定も、細胞表面における細胞外からのシグナル伝達により制御されるはずですが、未解明のままでした。
Ⅱ.研究の概要
神経細胞の細胞表面におけるシグナル伝達の制御メカニズムを明らかにするため、本研究チームは、以前、成長円錐(軸索形成に重要な先端部)で最も多く発現する膜タンパク質の1つとして同定したGPM6aに注目しました(Nozumi, Honda, Igarashi ら, PNAS, 2009)。
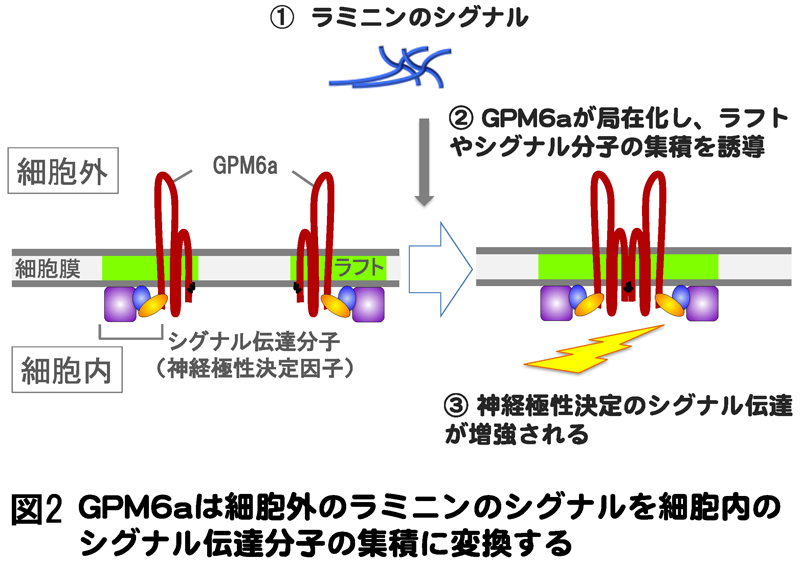
GPM6aは細胞膜で、ラフトに局在することを発見しました。GPM6aのラフトにおける局在と、ラフト自体の位置関係を調べたところ、正常なGPM6aは、自身が局在化する神経突起の先端にラフトを密集させましたが、ラフトに局在化できない変異型のGPM6aは、その集合を引起こさず、GPM6a局在が細胞表面のラフトの集合を作り出すことがわかりました。
また細胞外基質タンパク質の1つであるラミニンのシグナルが、GPM6aの偏った局在を作ることが分かりました。GPM6aが局在化した神経細胞では、ラフトがGPM6aと同様の、偏った分布を示していました。一方で、GPM6aが欠損した神経細胞では、ラミニンのシグナルがあっても、ラフトの局在化ができず、細胞外のラミニンシグナルにより、GPM6aは細胞表面で偏って局在化し、ラフトの集積を引起こすことを証明できました(図2)。
次に、GPM6aが細胞内で相互作用する分子を調べたところ、神経極性決定に関与するシグナル分子と複合体を形成することを見出しました。ラミニンシグナルによりGPM6aが局在化する際の、ラフトとシグナル分子群の分布を比較すると、両者がGPM6aと同様にラフトに集合しており、GPM6aの欠損した神経細胞では、ラフトもシグナル分子もそれぞれ細胞表面にバラバラに分布してしまうことが分かりました(図2)。
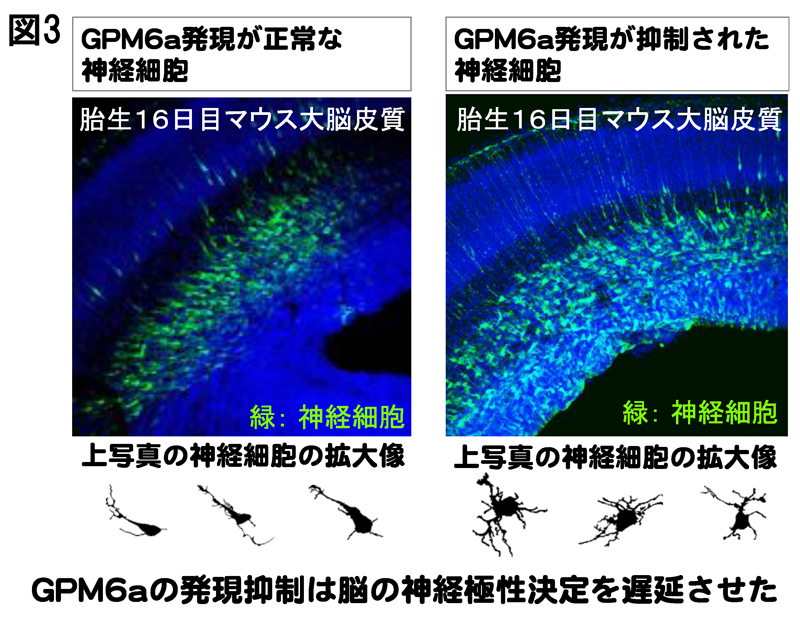
ラミニンのシグナルは、神経極性決定までの時間過程を著しく短縮し、GPM6aの欠損した神経細胞ではその作用が生じないことから、GPM6aがラフトと細胞内の神経極性決定シグナル分子の集積を引起こした結果、シグナル伝達の増強が生じて、速い神経極性の決定が誘導されることが明らかになりました。この結果は、マウス胎仔の脳内におけるGPM6aの発現の抑制が、脳神経細胞の神経極性決定を遅延させた結果(図3)と一致していました。
Ⅲ.研究の成果
今回の結果は、GPM6aという分子による、神経細胞外から細胞内へのラフトを介した新たなシグナル伝達制御機構を明らかにしました。
本研究において、GPM6aは細胞表面上のトランスデューサーとして、細胞外のラミニンシグナルに応じて、ラフトを介して神経極性決定のシグナル伝達を制御し、非常にスピーディーな神経極性決定を誘導しました。
本研究での、マウス脳におけるGPM6aの発現阻害による神経極性決定の遅延の知見は、GPM6aによるシグナル伝達制御が脳形成において重要な役割を持つことを示すと共に、慢性ストレスやウイルス感染などによるGPM6aの発現抑制が、精神疾患や神経疾患を誘発する可能性を明らかにしました。
Ⅳ.今後の展開
今回発見した、GPM6aをトランスデューサーとした脂質ラフトを介したシグナル伝達の制御機構は、神経極性決定過程だけでなく、他のシグナル伝達過程にも多様に機能している可能性が高いため、ラフトを介した脳のシグナル伝達の制御機構解明の鍵となります。
GPM6a発現の抑制は、うつ病やアルツハイマー病、BSEやHIV脳症などの、精神疾患や神経疾患を発症した患者ではGPM6aの発現量が顕著に低下しています。従って、臨床医療においてGPM6a発現量の測定が、これら疾患の発症診断の指標(バイオマーカー)として活用できることが期待されるだけなく、これらの疾患でのGPM6aによるシグナル伝達を明らかにすることで、疾患の発症原因の解明や、治療法の開発に大きく寄与できます。
Ⅴ.研究成果の公表
これらの研究成果は、2017年3月8日(米国時間)のThe Journal of Neuroscience誌(IMPACT FACTOR 6.780)オンライン速報版に掲載されました。
http://www.jneurosci.org/content/early/2017/03/08/JNEUROSCI.3319-16.2017
論文タイトル:Extracellular Signals induce Glycoprotein M6a Clustering of Lipid-rafts and associated Signaling Molecules
著者:Atsuko Honda¹,², Yasuyuki Ito¹, Kazuko Takahashi-Niki¹, Natsuki Matsushita³, Motohiro Nozumi¹, Hidenori Tabata⁴, Kosei Takeuchi¹,³ and Michihiro Igarashi¹,²
1) Department of Neurochemistry and Molecular Cell Biology, Graduate School of Medical and Dental Sciences
2) Transdiciplinary Research Programs, Niigata University, Niigata 951-8510, Japan
3) Department of Medical Biology, Aichi Medical University, Nagakute, Aichi 480-1195, Japan
4) Department of Molecular Neurobiology, Institute for Developmental Research, Aichi Human Service Center, Aichi 480-0392, Japan
DOI:https://doi.org/10.1523/JNEUROSCI.3319-16.2017
用語説明
1. シグナル伝達・トランスデューサー:
細胞は、外部の環境・状況に対応するために、その情報(シグナル)を、シグナル分子とよばれる因子から因子へ次々に化学的に伝達しあうことで、自らの挙動を決定する。シグナル伝達の経路は大きく分けて、細胞表面において細胞外から細胞内へシグナルを伝達する過程と、細胞内でのシグナルの伝達過程の2つに分けられる。前者では、細胞外の物理的・化学的シグナルが、細胞表面のトランスデューサーにより、細胞内シグナル分子によるシグナルに変換されて伝達される。
2. 脂質ラフト:
マイクロドメインとも呼ばれる細胞の膜上の、流動性(流れ)の低い微小な領域のこと。細胞の膜は主に流動性が高い脂質から成っているが、この部分はコレステロールと糖脂質に富み、流動性が低い(流れが遅い)。ここにシグナル分子などの、膜のタンパク質が集積し、細胞表面でのシグナル伝達をはじめ、細胞接着や細胞極性[用語解説4神経極性参照]、細菌・ウイルス感染などにおいて重要な場として機能すると考えられている。膜全体を水面に例えた場合、そこに浮かぶ筏(ラフト)のイメージから、脂質ラフトと呼ばれる。
3. 細胞外基質:
生体内で細胞と細胞の間を埋める構造体で、細胞の機能や分化を制御する細胞外の微小環境である。実際には細胞外基質は単なる隙間ではなく、シグナル伝達分子やその受容に関する分子群が多数存在している場所である。細胞外基質のシグナルは、シグナル伝達により細胞外から細胞内に伝えられる。
4. 神経(細胞)極性:
細胞極性とは、細胞の持つ空間的な極性(偏り)の総称で、神経細胞は、精巧な脳神経回路の形成や情報の伝達をおこなうため、高度に発達した細胞極性を形成している。神経極性により、通常、神経細胞は1つの細胞体から一本の長い軸索と複数の樹状突起を形成し、樹状突起で他の神経細胞から情報を受取り、細胞体で情報を統合、軸索により次の細胞へと情報を出力することができる。
本件に関するお問い合わせ先
新潟大学大学院医歯学総合研究科
分子細胞機能学分野 五十嵐道弘 教授
e-mail:tarokaja@med.niigata-u.ac.jp