希少疾患ファブリー病の多尿のメカニズム −ファブリー病モデルマウスで解明−
新潟大学大学院医歯学総合研究科腎医学医療センターの丸山弘樹特任教授らの研究グループは、多尿を呈するファブリー病モデルマウスを解析して、ファブリー病の多尿のメカニズムを明らかにしました。
【本研究成果のポイント】
・多尿を呈するファブリー病モデルマウスの尿細管障害を解析しました。
・障害が強い尿細管は、Na+の再吸収が盛んで、尿の濃縮に関わる髄質のヘンレの太い上行脚でした。
・ヘンレの太い上行脚(遠位直尿細管)でNa+の再吸収に関わる3つのタンパク質はいずれも発現が低下していました。
・糸球体障害は認められないにも関わらず、腎機能の低下が認められました。
・障害された尿細管の周囲に線維化を認め、腎機能の低下を来していました。
Ⅰ.研究の背景
ファブリー病は希少疾患であり、厚生労働省によって原因究明・治療法等の研究が強く推進さている難治性疾患克服研究事業の対象疾患の一つです。病態の解明は、効果的な治療提案に貢献する研究テーマです。
ファブリー病は細胞のライソゾーム内に存在する加水分解酵素であるα-ガラクトシダーゼAの遺伝子の変異による遺伝性疾患です。この酵素の働きが低下するので、糖脂質グロボトリアオシルセラミド(注釈1)を分解できません。糖脂質が全身の臓器の細胞に蓄積します。とりわけ、腎臓障害はファブリー病の予後に関わります。
研究テーマである多尿は、1958年、ファブリー病の初期症状として初めて報告されましたが、尿細管(注釈2)の障害部位とそのメカニズムは不明のままでした。腎臓での糖脂質の蓄積は、糸球体(注釈3)では目立ちますが、尿細管では気づかれにくいこと、従来のモデルマウスであるα-ガラクトシダーゼA遺伝子のノックアウトマウス(注釈4)が無症状であることが解明の障壁でした。
従来のモデルマウスに症状が認められない原因として、グロボトリアオシルセラミドの負荷が不十分であると考えました。2013年、本研究グループは、グロボトリアオシルセラミドの負荷を増やす目的で、グロボトリアオシルセラミド合成酵素遺伝子のトランスジェニックマウス(注釈5)を作って従来のモデルマウスと掛け合わせて、多尿を呈する新たなモデルマウスを作りました。
2008年、ファブリー病患者の剖検結果から、腎臓の深い所にある髄質の尿細管であるヘンレの太い上行脚(遠位直尿細管)に糖脂質が蓄積しやすいことが報告されました。
Ⅱ.研究の概要
マウスの腎臓は小さいので、腎臓全体を含む断面を作製することが可能であり、尿細管全体を俯瞰できます。糸球体で作られた原尿は、近位尿細管、ヘンレの太い上行脚(遠位直尿細管)、遠位曲尿細管、集合管を通る間に電解質や水の再吸収を受けて濃縮されます。
電解質や水を再吸収するために各尿細管に特異的なタンパク質が発現しています。そこで、これらのタンパク質に結合する抗体を用いた免疫染色でヘンレの太い上行脚(遠位直尿細管)、遠位曲尿細管、集合管を同定して、新たなモデルマウスの多尿のメカニズムを解析しました。
Ⅲ.研究の成果
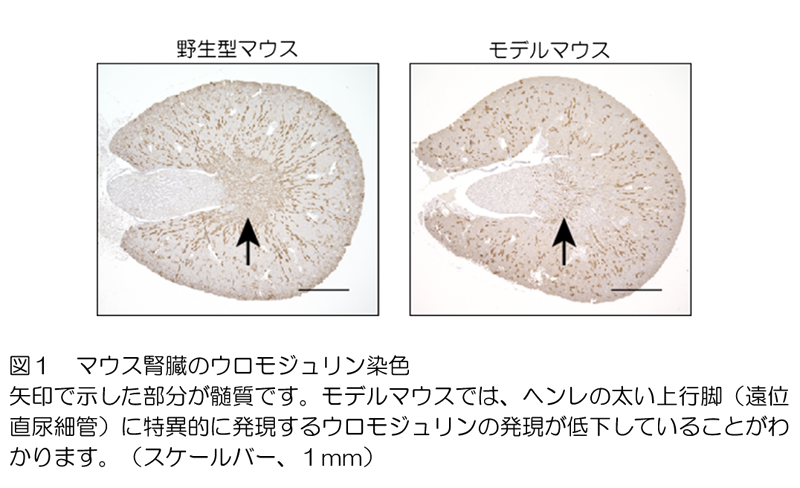
モデルマウスでは、糖脂質の蓄積が多く、障害の強い尿細管は髄質のヘンレの太い上行脚(遠位直尿細管)でした(図1)。
ヘンレの太い上行脚(遠位直尿細管)は、Na⁺の再吸収が盛んに行われて、尿の濃縮を担う尿細管です。皮質と比べて髄質は血流が乏しく、障害を受けやすいのです。糸球体障害は認められないにも関わらず、腎機能の低下(注釈6)が認められました。障害尿細管の周囲には線維化が認められて、これが腎機能障害を来していました。ヘンレの太い上行脚(遠位直尿細管)でNa⁺の再吸収に関わる3つのタンパク質−Na⁺-K⁺-2Cl⁻コトランスポーター、ウロモジュリン、Na⁺-K⁺-ATPase−(注釈7)はいずれも発現が低下していました。同様に、ファブリー病患者においても障害が強いのは髄質のヘンレの太い上行脚(遠位直尿細管)でした。
以上から、髄質のヘンレの太い上行脚(遠位直尿細管)障害が多尿の原因であると考えられました。
Ⅳ.今後の展開
腎生検では浅い所にある皮質が採取されます。深い所にある髄質の尿細管は採取できないことが多いです。今回の研究成果を基に、非侵襲的に尿所見で髄質のヘンレの太い上行脚(遠位直尿細管)の障害を検出する方法を開発することで、腎障害の早期発見が可能になり、尿細管障害に着目した治療方法の提案が可能になると思います。
用語解説
注釈1)グロボトリアオシルセラミド
グロボトリアオシルセラミドは、α-ガラクトシダーゼAが分解する物質(基質)であり、ファブリー病で蓄積する代表的な糖脂質です。
注釈2)尿細管
糸球体でろ過されてできたろ液(原尿)は、膀胱で尿として貯められるまでに、尿細管で必要な電解質やタンパク質などが再吸収されて、水分量も調整されます。原尿の99%は体内に再吸収されて、最終的には1%が尿として体外に排泄されます。尿細管は、尿の流れに沿って近位尿細管、ヘンレの太い上行脚(遠位直尿細管)、遠位曲尿細管、集合管があります。尿細管によって機能と形態が異なります。
注釈3)糸球体
腎臓の糸球体では、血液がろ過されて原尿(尿のもと)が作られます。
注釈4)α-ガラクトシダーゼA遺伝子のノックアウトマウス
遺伝子操作でα-ガラクトシダーゼA遺伝子が破壊されて無効化された遺伝子組み換えマウスです。このノックアウトマウスは、α-ガラクトシダーゼAが作られませんが、無症状です。病態の解明には、症状を呈するモデルマウスが必要です。
注釈5)グロボトリアオシルセラミド合成酵素遺伝子のトランスジェニックマウス
グロボトリアオシルセラミド合成酵素遺伝子を遺伝子操作で導入して、グロボトリアオシルセラミドを過剰に発現させたマウスです。
注釈6)腎機能の低下
尿を産生する糸球体と尿細管をあわせてネフロンと呼びます。正常に機能するネフロンが減る腎機能が低下します。
注釈7)Na⁺-K⁺-2Cl⁻コトランスポーター、ウロモジュリン、Na⁺-K⁺-ATPase
ヘンレの太い上行脚(遠位直尿細管)がNa⁺を尿中から再吸収するには、細胞内に配置された以下の3つの装置が必要です。Na⁺-K⁺-2Cl⁻コトランスポーターのほとんどがヘンレの太い上行脚(遠位直尿細管)に存在します。Na⁺-K⁺-2Cl⁻コトランスポーターは尿細管腔側に存在して尿中Na⁺を細胞内に輸送します。ウロモジュリンはヘンレの太い上行脚(遠位直尿細管)特異的に存在します。ウロモジュリンは尿細管腔側を主体に細胞全体に存在してNa⁺-K⁺-2Cl⁻コトランスポーターの働きを促進します。Na⁺-K⁺-ATPaseは、尿細管基底側に存在して尿中Na⁺を細胞外に輸送します。Na⁺の再吸収が盛んに行われるヘンレの太い上行脚(遠位直尿細管)では、Na⁺-K⁺-ATPaseが高密度に存在します。
Ⅴ.研究成果の公表
これらの研究成果は、平成30年3月19日のFASEB J誌(IMPACT FACTOR 5.498)online版に掲載されました。
論文タイトル:Medullary thick ascending limb impairment in the GlatmTg(CAG-A4GALT) Fabry model mice
著者:Hiroki Maruyama*, Atsumi Taguchi, Yuji Nishikawa, Chu Guili, Mariko Mikame, Masaaki Nameta, Yutaka Yamaguchi, Mitsuhiro Ueno, Naofumi Imai, Yumi Ito, Takahiko Nakagawa, Ichiei Narita, Satoshi Ishii.
*: corresponding author
doi: org/10.1096/fj.201701374R
本件に関するお問い合わせ先
新潟大学医歯学総合研究科 腎医学医療センター
特任教授 丸山弘樹
E-mail:hirokim@med.niigata-u.ac.jp