�ߥȥ���ɥꥢ�����ȥե��������������뿷����������Ҥ�ȯ��
���������ر���������縦��ʵ�ǽ�����ʬ��θ������Ϻ��Ǥ�����������Ҿ涵����θ��楰�롼�פϡ�������������̿�����ر��������νڶ�����Ȥζ�Ʊ����ˤ�ꡢ����ѥ���æ����������Ppg1�����ߥȥ���ɥꥢ�����ȥե���������1�ˡʰʲ����ޥ��ȥե������ˤ���������������ҤȤ��Ƶ�ǽ���Ƥ��뤳�Ȥ�ȯ�����ޤ������ޥ��ȥե������ϡ���������������뤤��;���¸�ߤ���ߥȥ���ɥꥢ��ʬ�뤳�Ȥǡ��ߥȥ���ɥꥢ�ι�������ݻ�������פʺ�˦�ʼ����������Ǥ����ܸ���ϡ��ޥ��ȥե��������浡�������Ʋ����ؿ�����ƻ����Ϸ����ߥȥ���ɥꥢ��ǽ�㲼���ؤ���͡��ʼ�����ͽ�ɡ����Ťλ���Ȥʤ����̤Ǥ���
��
���ܸ������̤Υݥ���ȡ�
���ޥ��ȥե������쥻�ץ���Atg32��æ��������𤷤ƥޥ��ȥե���������������æ����������Ppg1��Ʊ�ꤷ����
��Ppg1�ޤ���Farʣ���Ρ�Ppg1�η����ҤȤ���Ʊ��ˤη�»�ϡ�Atg32�ι���Ū�ʥ���������ӥޥ��ȥե�������ж�ʤ��������������
��Atg32��151-200�κ�˦���ΰ褬�ޥ��ȥե������������˽��פǤ��뤳�Ȥ����餫�Ȥʤä���
������ѥ������������Ǥ�æ���������ǡ���2�ˤζ���ˤ��ޥ��ȥե������ο��������浡����ǥ��������
��
Ⅰ��������ط�
�ߥȥ���ɥꥢ�ϡ���˦��ɬ�פȤ��륨�ͥ륮������Ⱦ���������˦�⾮�ﴱ�ǡ���̿��ư��Ԥ�������˽��פ�����̤����Ƥ��ޤ������ͥ륮�������β����ǽ��Ĥ����ߥȥ���ɥꥢ�Ϻ�˦�ˤȤä�ͭ���Ǥ��ꡢ�ߥȥ���ɥꥢ�Τߤ�ɸŪ�Ȥ��륪���ȥե������ʰʲ����ޥ��ȥե������ˤˤ�äƽ�����ɬ�פ�����ޤ����ޥ��ȥե������ε�ǽ����þ������˦������ɥߥȥ���ɥꥢ�����Ѥ���ȡ�����������������3�ˤ�Ϸ�����ݤʤɤ��װ��Ȥʤ�ޤ����ޥ��ȥե������ϡ��ߥȥ���ɥꥢ��Ϣ�������Ťλ���Ȥ������ܤ���Ƥ��ꡢ���줫��ҥȤޤ�¿�����Ϥ�ޥ��ȥե�������ʬ�ҵ���������Ū�յ������Ʋ����ϵ�̳�ȤʤäƤ��ޤ���
�ܸ��漼�Ǥϡ������ޥ��ȥե������Υ�ǥ���ʪ�Ȥ����Ѥ��ơ��ޥ��ȥե������Υ쥻�ץ�������4�ˤȤ��Ƶ�ǽ����Atg32��Ʊ���Kanki�顢Dev Cell��2009�ˤ����ڤ�ˡ��ޥ��ȥե�������ʬ�ҵ���������ʬ�����餫�ˤ��Ƥ��ޤ�����2013ǯ�ˡ�Atg32���������ʡ���2�ʰʲ���CK2�ˤȤ������Ǥˤ�äƥ���������뤳�Ȥ��ޥ��ȥե������ΰ�����Ȥʤ뤳�Ȥ�ȯɽ���ޤ�����Kanki�顢EMBO Rep�ˡ��������ʤ��顢CK2�Ͼ�˳�������ä����֤Ǻ�˦������̤�¸�ߤ���ˤ⤫����餺��Atg32�Υ������ϥޥ��ȥե�����ͶƳ���Τߵ����븽�ݤǤ��뤳�Ȥ��顢�̾��ﲼ�ǤϤɤΤ褦�˥���������������Ƥ���Τ��������ΤޤޤǤ�����
��
Ⅱ������γ��פ�����
Atg32�Υ�����������������Ҥ�õ��������ˡ�Ȥ��ơ��ޥ��ȥե�������ͶƳ�����ȡ�Atg32����������¸Ū�˥ߥȥ���ɥꥢ��˥ɥåȾ��˽��Ѥ��븽�ݤ����ܤ��ޤ������ޥ��ȥե�������ͶƳ�����ˤ��Τ褦����ħ���Ѱ۳���õ�������Ȥ�����æ����������Ppg1��Ʊ�ꤵ��ޤ�����Ppg1���»������ȡ�CK2��¸Ū��Atg32�ι���Ū�ʥ������������ꡢ���η�̤Ȥ��ƥޥ��ȥե�������ж�ʤ������ޤ�������̣�������Ȥˡ�Atg32�Υ����������Ǥϥޥ��ȥե������ϿʹԤ����������ȥե������Υ����Ȥʤ���ʬ��Ʊ���˳���������뤳�Ȥ����פǤ��뤳�Ȥ�ʬ����ޤ������ޤ����ޥ��ȥե������ʳ��Υ����ȥե��������㤨�Хڥ륪����������Ȥ�����˦�⾮�ﴱ��ʬ��ڥ����ե������䤽�Υ쥻�ץ����Ǥ���Atg36������ˤ�Ppg1�ϴ�Ϳ���ʤ����Ȥ�ʬ����ޤ�����
Ppg1��°����PP2A�ե��ߥ��æ���������ǡ���5�ˤϡ�����Ĵ����Ҥȷ�礷�Ƶ�ǽ��ȯ�����뤳�Ȥ��Τ��Ƥ��ޤ����������ʤ��顢Atg32��æ�������ˤ�Ppg1�ϴ��Τγ���Ĵ����Ҥ�ɬ�פȤ��ʤ��ä����Ȥ��顢̤�Τΰ��Ҥ���Ϳ����ȿ�¬���ޤ����������ǡ�Ppg1�ȷ�礹����Ҥ�ץ��ƥ�������ϡ���6�ˤȤ�����ˡ��õ�������Ȥ�����Farʣ���Ρ�Far3��7��8��9��10��11��6����ѥ�����������ˤ�Ʊ�ꤵ��ޤ�����Farʣ���Τ��»������ȡ�Ppg1��»��Ʊ�ͤ�Atg32�ι���Ū�ʥ������ȥޥ��ȥե�������ж�ʤ������ޤ�����
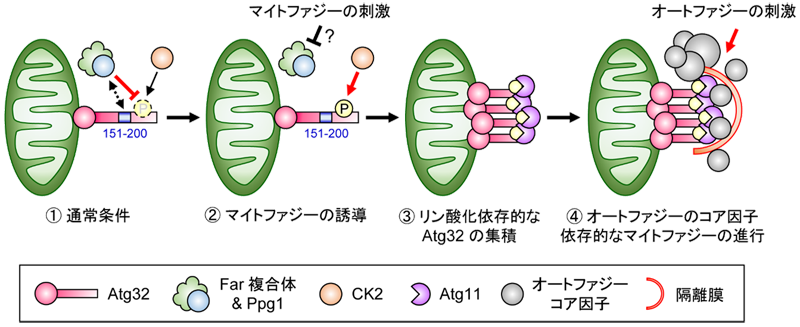
�Ǹ�ˡ��ޥ��ȥե�������������Atg32����ѥ����Τɤ��ΰ褬���פʤΤ���Ĵ�٤ޤ�����Atg32�Υ��ߥλ�����151-200���ܤ��ΰ���»������ȡ�Ppg1��»�Ȥۤ�Ʊ�ͤη�̤Ȥʤä����Ȥ��顢Ppg1�Ϥ����ΰ��𤷤�Atg32��æ���������Ƥ���ȿ�¬����ޤ������ʾ�η�̤��Ȥˡ���1�˼����줿�ޥ��ȥե����������浡�������ޤ�����
��
��1 �ޥ��ȥե����������浡����ǥ�
���̾��ﲼ�Ǥ�Ppg1-Farʣ���Τκ��Ѥˤ�ä�Atg32�Υ���������������Ƥ��롣���ޥ��ȥե�������ͶƳ��ﲼ�Ǥϡ�Ppg1-Farʣ���Τ���CK2��ͥ�̤�Ư����Atg32�Υ������������롣��Atg32�Υ���������ӥ����ץ�������ѥ���Atg11��¸Ū��Atg32�ϥߥȥ���ɥꥢ��˽��Ѥ��롣�������ȥե������Υ������Ұ�¸Ū�˥ޥ��ȥե��������ʹԤ��롣
��
���Ѹ�������
����1�˥����ȥե�����
��˦����ʬ���ȥե���������ȸƤФ����������߹��ߡ���˦���뤤�ϥ�������ʬ�����ܸ��κ����Ѥ���Ĥ�����˦���ﴱ�ʥߥȥ���ɥꥢ���ڥ륪���������ࡢ��˦�Τʤɡˤ��ӽ�������줫��ҥȤޤ��������פ�������ǽ�Ǥ��롣�����ȥե������ˤϡ���˦����ʬ��������Ū�˴ݤ���ʬ��Х륯�����ȥե���������˦���ﴱ������ι��ǤΤߤ�����Ū��ʬ������Ū�����ȥե��������礭��ʬ�व��롣�ܸ���Ǥϡ��ߥȥ���ɥꥢ������Ū��ʬ��ޥ��ȥե������˾��������ƤƤ��롣
��
����2�˥���ѥ������������Ǥ�æ����������
¿���Υ���ѥ����ϡ�����Υ��ߥλ��ʥ�����쥪�˥�������ˤ�����ѥ������������Ǥˤ�äƥ������Ȥ�������������뤳�Ȥˤ�äơ�����Ω�ι�¤���Ѳ����������ξ徺���㲼���뤤��¾�Υ���ѥ����Ȥη����Υ�ʤɤ������롣���������줿����ѥ����ϡ�æ���������Ǥˤ�ä�æ����������롣
��
����3�˿�����������
���Ф���������к�˦���ȼ���µ������ΤǤ��ꡢ����ĥϥ��ޡ��¡��ѡ������¡��ϥ����ȥ��¡��ڰ����¦���Ų��ɡ�ALS�ˤʤɤ��Τ��Ƥ��롣��ǯ���ѡ������¤ϥޥ��ȥե������ΰ۾郎�����ΰ�Ĥ��ȹͤ����Ƥ��롣
��
����4�˥ޥ��ȥե������Υ쥻�ץ���
�ߥȥ���ɥꥢ���¸�ߤ���ޥ��ȥե��������ܰ��Ȥʤ륿��ѥ���������Ǥ�Atg32���Τ��Ƥ��뤬���ҥȤǤ�PINK1/Parkin��¸Ū�ʥޥ��ȥե�������PINK1/Parkin���¸Ū�ʥޥ��ȥե������쥻�ץ�����Nix��BNIP3��FKBP8��FUNDC1��Bcl2-L-13�ʤɡˤ�¸�ߤ��롣
��
����5��PP2A�ե��ߥ��æ����������
����Ǥϡ�Pph21��Pph22��Pph3��Sit4��Ppg1���Τ��Ƥ��롣Pph21��Pph22�ϡ�Tpd3��Cdc55��Rts1�ȷ�礷��Sit4��Sap4��Sap155��Sap185��Sap190�ȷ�礹�뤳�Ȥ�æ���������ǤȤ��Ƥε�ǽ��ȯ�����롣�ܸ���Ǥϡ�Ppg1��Farʣ���Τȶ�ĴŪ��Ư�����Ȥ���¬���줿��
��
����6�˥ץ��ƥ��������
��˦�⳰�Υ���ѥ���������Ū�˲��Ϥ�����ˡ���ܸ���Ǥϡ�����ʬ�����֤��Ѥ���Ppg1�ȷ�礹�륿��ѥ�������Ʊ�ꤷ����
��
Ⅲ�������Ÿ��
�ޥ��ȥե�������ͶƳ��ﲼ�ˤ����ơ�Ppg1��Farʣ���Τ�̤�����Υ����ʥ�ˤ�ä��Գ��������졢Atg32��æ���������뤳�Ȥ��Ǥ��ʤ��ʤꡢ���Ū��Atg32��CK2�ˤ��������������ȿ�¬����ޤ�������ϡ����Υ����ʥ�����ΤȾܺ٤�ʬ�ҵ��������餫�ˤ��뤳�Ȥǥޥ��ȥե����������浡�������Ʋ������ܻؤ��ޤ���
��
Ⅳ���������̤θ�ɽ
�����θ������̤ϡ�������ظ����ʵ����ε���˭��Ǥ���翦����������������̿�����ر��������νڶ����Ȥζ�Ʊ���������줿��Τǡ�ʿ��30ǯ6��20������1�������ܻ��֡ˤ�Cell Reports���IMPACT FACTOR 8.282�ˤ˷Ǻܤ���ޤ�����
��ʸ�����ȥ롧The PP2A-like protein phosphatase Ppg1 and the Far complex cooperatively counteract CK2-mediated phosphorylation of Atg32 to inhibit mitophagy
��
���ԡ�Kentaro Furukawa¹,*, Tomoyuki Fukuda¹, Shun-ichi Yamashita¹, Tetsu Saigusa¹, Yusuke Kurihara¹,⁵, Yutaka Yoshida²,³, Hiromi Kirisako⁴, Hitoshi Nakatogawa⁴, and Tomotake Kanki¹,*
��
1��Department of Cellular Physiology, Niigata University Graduate School of Medical and Dental Sciences, Niigata 951-8510, Japan
2��Department of Structural Pathology, Kidney Research Center, Niigata University Graduate School of Medical and Dental Sciences, Niigata 951-8510, Japan
3��Institute for Research Promotion, Niigata University, Niigata 950-2181, Japan
4��School of Life Science and Technology, Tokyo Institute of Technology, Yokohama 226-8501, Japan
5��Present address: Department of Microbiology and Immunology, Faculty of Medicine, Fukuoka University, Fukuoka 814-0180, Japan
*��Corresponding authors
��
doi: 10.1016/j.celrep.2018.05.064
��
��
�ܷ�˴ؤ��뤪�䤤��碌��
���������ر���������縦��� ��ǽ�����ʬ��
�����Ҿ�ʤ��Ȥ⤿���� ����
E-mail��kanki@med.niigata-u.ac.jp