老化細胞を選択的に除去するGLS1阻害剤が加齢現象・老年病・生活習慣病を改善させることを証明
1.発表者:
中西 真(東京大学医科学研究所 癌防御シグナル分野 教授)
城村 由和(東京大学医科学研究所 癌防御シグナル分野 助教)
古川 洋一(東京大学医科学研究所 臨床ゲノム腫瘍学分野 教授)
井元 清哉(東京大学医科学研究所 健康医療インテリジェンス分野 教授)
中山 敬一(九州大学生体防御研究所 分子医科学分野 主幹教授)
松本 雅記(新潟大学大学院医歯学総合研究科 オミクス生物学分野 教授)
末松 誠(慶應義塾大学医学部 医化学教室 教授)
杉浦 悠毅(慶應義塾大学医学部 医化学教室 専任講師)
有田 誠(理化学研究所 メタボローム研究チーム チームリーダー)
杉本 昌隆(国立長寿医療研究所 老化機構研究部 室長)
2.発表のポイント:
◆老化細胞はリソソーム(注1)膜に損傷が生じることで細胞内pHが低下すること、その結果としてグルタミン代謝酵素GLS1(注2)の阻害剤に感受性を示すことを明らかにしました。
◆老齢マウスや加齢関連疾患モデルマウスへのGLS1阻害剤の投与により、さまざまな臓器・組織の加齢現象や老年病、生活習慣病を改善できることも見いだしました。
◆本研究成果により、老化細胞の代謝特異性を標的とした老化細胞の除去による新たな抗加齢療法の開発に貢献することが期待されます。
3.発表概要:
細胞はさまざまなストレスを受けると、不可逆的な増殖停止を示す老化細胞に誘導されることが知られています。これまでに、老化細胞は加齢に伴い生体内に蓄積することや、老齢マウスから遺伝子工学的に老化細胞を除去すると、動脈硬化や腎障害などの老年病の発症が有意に遅れ、健康寿命も延伸することが示されていました。しかし、組織・臓器により老化細胞は多様性を有することが分かっており、多様な老化細胞を除去するための薬剤の開発やその標的の同定には至っていませんでした。
東京大学医科学研究所の城村由和助教(癌防御シグナル分野)、中西真教授(癌防御シグナル分野)らの研究グループ(※1.発表者を参照)は、新たな老化細胞の純培養法を構築し、老化細胞の生存に必須な遺伝子群をスクリーニングにより探索した結果、グルタミン代謝に関与するGLS1を同定しました。
またGLS1の発現解析により、老化細胞はリソソーム膜に損傷が生じ、細胞内pHが低下することで、GLS1の阻害に対する感受性が亢進することも明らかにしました。さらに老齢マウスにGLS1阻害剤を投与すると、さまざまな組織・臓器における老化細胞が除去され、加齢現象が有意に改善しました。
加えて、さまざまな加齢関連疾患モデルマウスに対するGLS1阻害剤の効果を検討した結果、肥満性糖尿病、動脈硬化症、および非アルコール性脂肪肝(NASH、注3)の症状改善に有効であることも見いだしました。
本研究成果により、老化細胞の代謝特異性やそれに起因する脆弱性が明らかとなり、それらを標的とする薬剤を開発することで健康寿命の亢進のみならず「がん」や「動脈硬化」などのさまざまな老年病の予防・治療への展開も期待されます。
本研究成果は、2021年1月15 日(米国東部時間)、米国の国際科学雑誌「Science」に公表されます。
4.発表内容:
これまでの研究では、遺伝子工学的実験手法により、マウス個体から老化細胞を除去することで加齢に伴うさまざまな症状の改善や健康寿命の亢進、さらには動脈硬化症などの加齢関連疾患の病態が改善することが報告されてきました。しかし最近になり、生体内に存在する老化細胞は多様性を有することが分かってきており、広範な老化細胞を標的とした老化細胞除去薬の開発に至っていませんでした。
本研究グループは、老化細胞の生存に必須な遺伝子群を探索するために、これまでの研究成果を基に新たな純化老化細胞の作製法を構築しました。この新しい作製法は、p53遺伝子をG2期で活性化させるもので、非常に効率的に細胞老化が誘導でき、他の誘導系で作製した老化細胞と同じ性質をもっています。
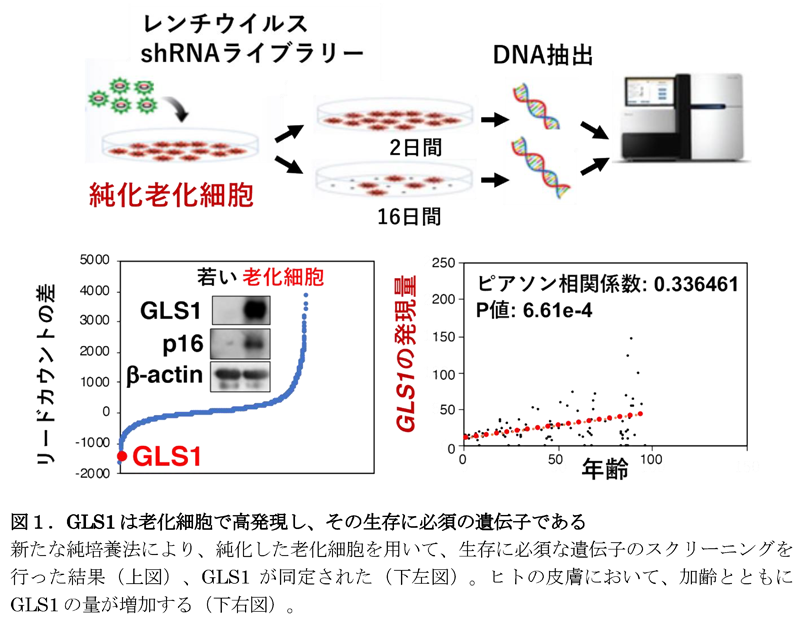
この純化老化細胞を用いてレンチウイルスshRNAライブラリースクリーニング(注4)にて老化細胞の生存に必須な遺伝子群の探索を行った結果、グルタミン代謝に関与するGLS1が有力な候補遺伝子として同定されました(図1下段左)。そこで、老化細胞におけるGLS1の発現変化を解析したところ、細胞の種類や老化誘導要因にかかわらず、老化細胞においてGLS1アイソフォームの一つであるKGA(注5)の発現が顕著に増加していることが分かりました。また、ヒトの皮膚においても、KGAの発現と年齢に正の相関があることも判明しました(図1右下)。さらに正常細胞、および老化細胞の生存に対するGLS1阻害剤の影響を検討したところ、老化細胞を選択的に死滅させることが確認されました。
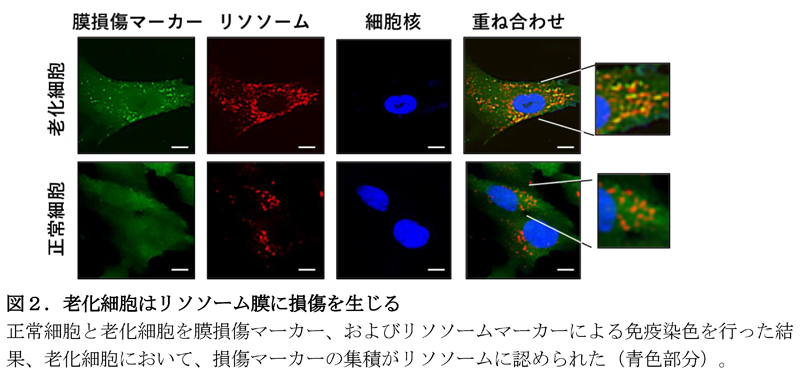
これまでのラット腎臓を用いた報告では、KGAの発現は細胞内pHの低下により発現が上昇することが示されていました。細胞内のpHの調節にはリソソームと呼ばれる細胞内小器官が重要な役割を果たすことから、リソソームの動態について解析を行い、老化細胞においてリソソーム膜に損傷が生じること(図2)、その原因が老化細胞のさまざまな遺伝子の過剰発現によるタンパク質凝集体の形成であることを明らかにしました。興味深いことに、老化細胞においてGLS1を阻害すると、細胞内pHが大きく低下することで細胞死が誘導されること、そして細胞培養液のpHを弱塩基性にすることやアンモニアを過剰添加することでGLS1阻害による細胞死が抑制されることも分かりました。GLS1は、グルタミンをグルタミン酸へと変換すると、エネルギー代謝に重要な代謝産物とともにアンモニアを産生することは古くから知られていましたが、アンモニアの産生はあくまで副産物であると考えられており、その生理・病理的意義については不明でした。本研究で解明された分子メカニズムにより、老化細胞は、細胞内pHの低下に伴い、GLS1の量を増加することで過剰なアンモニアを生成し、細胞内pHの恒常性を調節することで生存を維持できることが示唆されました。
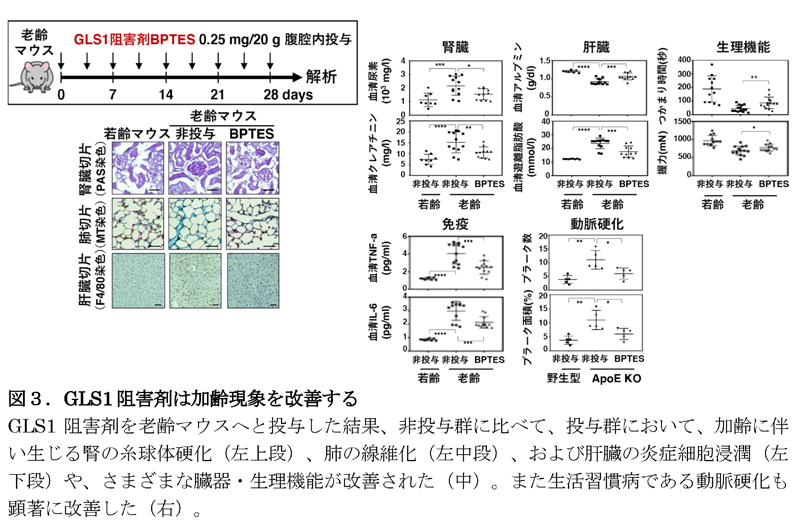
最後に、加齢現象に対するGLS1阻害剤の有効性を検証するために、老齢マウスにGLS1阻害剤を投与したところ、さまざまな臓器・組織において老化細胞の除去が確認でき、加齢性変化の特徴として知られている腎臓の糸球体硬化(注6)、肺の線維化(注7)、さらには肝臓の炎症細胞浸潤といったさまざまな症状が改善することが可能であることが分かりました(図3)。また、老化に伴う筋量低下による運動能力低下や脂肪組織萎縮による代謝異常を生じることが知られていますが、GLS1阻害剤の投与により、これらの進行も抑制されました。さらに、さまざまな加齢関連疾患モデルマウスへGLS1阻害剤を投与したところ、肥満性糖尿病、動脈硬化、およびNASHの症状が緩和されることも分かりました。
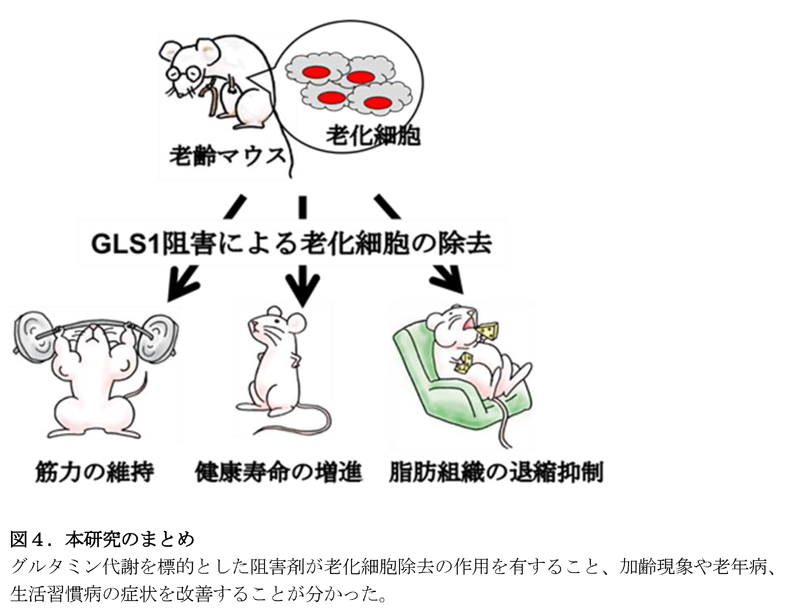
本研究成果により、リソソーム膜損傷によるグルタミン代謝の亢進が老化細胞の脆弱性の分子基盤であることを明らかにすることができました。さらにGLS1阻害剤が生体内における老化細胞の除去に有効であること、その結果として、さまざまな加齢現象や老年病、生活習慣病の改善に有効であることが示されました(図4)。現在、GLS1阻害剤は有効ながん治療薬として臨床試験中であり、本研究を足掛かりとして、GLS1阻害剤を用いた老化細胞除去による革新的な抗加齢療法や、「がん」を含めた老年病や生活習慣病の予防・治療薬の開発にも繋がることが期待されます。
本研究は、国立研究開発法人日本医療研究開発機構 老化メカニズムの解明・制御プロジェクト「老化研究推進・支援拠点」、およびJSPS科研費(JP26250027, JP22118003, JP16K15239, JP18H05026, JP16H06148, JP16K15238)の支援により実施されました。
※共同研究グループの末松誠 慶應義塾大学医学部 医化学教室 教授は、AMEDの研究費を受給しておりません。
5.発表雑誌:
雑誌名:Science
論文タイトル:Senolysis by glutaminolysis inhibition ameliorates various age-associated disorders
著者:Yoshikazu Johmura*, Takehiro Yamanaka$, Satotaka Omori$, Teh-Wei Wang$, Yuki Sugiura, Masaki Matsumoto, Narumi Suzuki, Soichiro Kumamoto, Kiyoshi Yamaguchi, Seira Hatakeyama, Tomoyo Takami, Rui Yamaguchi, Eigo Shimizu, Kazutaka Ikeda, Nobuyuki Okahashi, Ryuta Mikawa, Makoto Suematsu, Makoto Arita, Masataka Sugimoto, Keiichi I. Nakayama, Yoichi Furukawa, Seiya Imoto, and Makoto Nakanishi* (*共同責任著者、$共同第二著者)。
6.注意事項:
日本時間1月15日(金)午前4時 (米国東部標準時間:14日(木)午後2時)以前の公表は禁じられています。
7. 用語解説:
(注1)リソソーム
真核生物の細胞小器官の一つである。リソソームの内腔はpH5前後に酸性化されており種の加水分解酵素を含む構造体で細胞内消化の場である。
(注2)GLS1
グルタミナーゼ1の略称。アミドヒドラーゼ酵素の一種で、グルタミンからグルタミン酸、およびアンモニアを産生する。
(注3)非アルコール性脂肪肝(NASH)
アルコール非依存的に肝臓に脂肪が蓄積し炎症や繊維化が起きてしまう疾病。進行すると肝硬変や肝臓がんになる。
(注4)レンチウイルスshRNAライブラリースクリーニング
細胞内に存在するさまざまなmRNA(DNAのアミノ酸を決める部分)に対応するshRNAを合成し、それらをレンチウイルスベクターを用いて細胞に導入することで、各々のmRNAから合成されるタンパク質の発現を抑制することで個々のタンパク質の機能を網羅的に調べる方法のこと。
(注5)KGA
GLS1のアイソフォームの一つ。腎臓尿細管の上皮細胞に発現することが知られている。
(注6)糸球体硬化
腎皮質深層(皮髄境界)の一部の糸球体(巣状)に分節状の硬化が見られることで特徴づけられる病理形態。
(注7)線維化
皮膚や内臓に膠原線維(コラーゲン)などの細胞外基質と呼ばれる 物質が増加し、皮膚や内臓が硬くなる病理形態。
8.問い合わせ先:
〈研究に関すること〉
東京大学医科学研究所 癌防御シグナル分野
教授 中西 真(なかにし まこと)
E-mail:mkt-naka@ims.u-tokyo.ac.jp
九州大学生体防御医学研究所 分子医科学分野
主幹教授 中山 敬一(なかやま けいいち)
E-mail:nakayak1@bioreg.kyushu-u.ac.jp
新潟大学大学院医歯学総合研究科 オミクス生物学分野
教授 松本 雅記(まつもと まさき)
E-mail:masakim@med.niigata-u.ac.jp
慶應義塾大学医学部 医化学教室
専任講師 杉浦 悠毅(すぎうら ゆうき)
E-mail:yuki.sgi@keio.jp
国立長寿医療研究センター 老化機構研究部
免疫研究室長 杉本 昌隆(すぎもと まさたか)
E-mail:msugimot@ncgg.go.jp
〈報道に関すること〉
東京大学医科学研究所 国際学術連携室(広報)
Tel:090-9832-9760 E-mail:koho@ims.u-tokyo.ac.jp
九州大学 広報室
Tel:092-802-2130 E-mail:koho@jimu.kyushu-u.ac.jp
新潟大学 広報室
Tel:025-262-7000 E-mail:pr-office@adm.niigata-u.ac.jp
慶應義塾大学信濃町キャンパス総務課
Tel:03-5363-3611 Fax:03-5363-3612
E-mail:med-koho@adst.keio.ac.jp
国立長寿医療研究センター 総務部総務課
Tel:0562-46-2311(内線4623) E-mail:r-satomura@ncgg.go.jp
〈AMEDの事業に関すること〉
国立研究開発法人 日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
老化メカニズムの解明・制御プロジェクトについて
E-mail:aging@amed.go.jp
9.添付資料: